(8分)某同学用某种粗盐进行提纯实验,步骤见下图。请回答下列问题: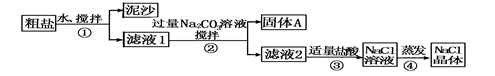
(1)步骤①和④的操作名称分别是 , 。
(2)步骤③判断加入盐酸“适量”的方法是 。
(3)猜想和验证:(并完成相应填空)
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
__________ |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 |
取少量固体A于试管中,先滴入________ ,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
______ |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水, |
__________ |
猜想Ⅲ成立 |
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图l所示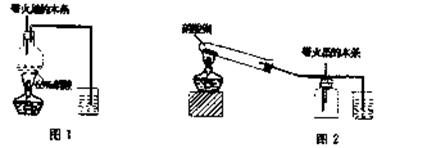
(1)浓硝酸受热分解的化学方程式是。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?——(填“正确,,或“不正确),理由是。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
。
(2)当集气瓶中充满红棕色 气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是____。
气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是____。
III.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
某校化学小组学生利用下图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)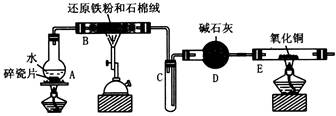
(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是:
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: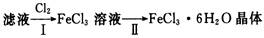
①步骤I中通入Cl2的作用是
②该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答: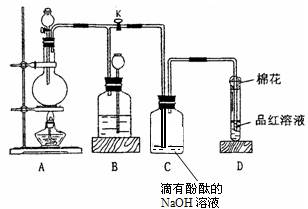
(1)装置A中发生的化学反应方程式为_____________________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是(用离子方程式表示)_________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同。C中是由于,而D中则是由于。
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质 量。
量。
A.比mg多 B.比mg少 C.恰好为mg
(2)溶解样品时要加入盐酸,原因是。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是。
(4)加入溴水时发生反应的离子方程式是。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl②Fe2(SO4)3
纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是;
(2)操作A的步骤为;
(3)检验“水洗”已经洗净的方法是;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为;
②产品中CaO2的质量分数为(用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示)。