下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 
(1)装置B中①的名称是 ,若用CCl4来萃取碘水中的碘,静置后,碘的CCl4溶液在 层,呈 色;回收碘的CCl4溶液中的CCl4选择装置__ _ ___(填代表装置图的字母)。
(2)为除去粗盐中的Ca2+、Mg2+、SO以及泥沙等杂质,某同学利用相关装置设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
Ⅰ.步骤①的操作名称是 ▲ 。
Ⅱ.第④步中,加入的试剂是__ ▲____(填化学式),该步骤中涉及的离子反应方程式为:
__ ▲__ __, ▲ 。
Ⅲ.判断第⑥步盐酸已“适量”的方法是__ ▲__ __。
Ⅳ.假设按照上述流程准确规范完成后,最后得到的精盐固体的质量为m1;若没有进行第⑥步,第⑤步完成后直接进行第⑦步得到的精盐固体质量为m2;则m1__ ▲__ __m2。(填“大于”或“小于”或“等于”)
(共14分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____________________(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________________________________,用少量蒸馏水洗涤后,再__________________________________________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_____________________________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。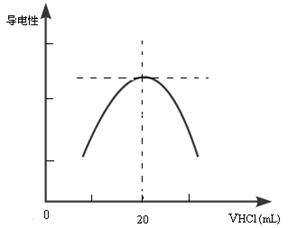
写出氨水与盐酸反应的离子方程式___________________________________________;该氨水样品的物质的量浓度为__________________________。若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果。(填偏高、偏低、无影响)
实验室有CuO和铜粉的混合物。要测定该样品(已称得其质量为m g)中氧化铜的质量分数。用下图所示仪器装置制取H2,再用H2还原CuO,最后根据样品质量的减少和无水CaCl2质量的增加来测定样品中氧化铜的质量分数。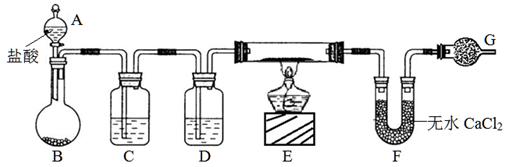
请回答:
(1)仪器中装入的试剂:D。
(2)操作“①打开A的活塞”和“②点燃E处酒精灯”应该先进行的是(填序号),在这两步操作之间还应进行的操作是:。
(3)若实验中有部分CuO被还原为红色的Cu2O,对实验的影响为_____(偏大、偏小、无影响)。
(4)若测得的原质量为a g的硬质玻璃管(E),反应后质量变为b g;U型管实验后质量增加n g,由以上数据可以列出计算氧化铜质量分数的两个不同计算式:
计算式1:;计算式2:。
I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是。实际称量的碳酸钠晶体质量为g。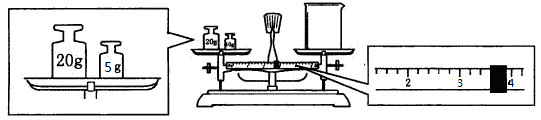
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是。
| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
E.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
F.容量瓶不干燥
(4)从容量瓶中取该溶液40 mL,与5 mol/L的NaOH溶液mL恰好完全反应,反应后溶液中的c(Na+)=(忽略溶液混合过程中的体积变化)
I.某氯化钠固体样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,步骤如下(用于沉淀的试剂稍过量):
步骤②③依次加入的试剂是。
II.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取单质碘(I2)的流程如下:
(1)①~⑥中发生化学变化的是。
(2)步骤⑤所使用的玻璃仪器名称是,选择的有机试剂可以是。
A.酒精 B.四氯化碳 C.醋酸 D.苯
(3)步骤⑥从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏(如下图所示)。冷水的流向为到。(填A、B)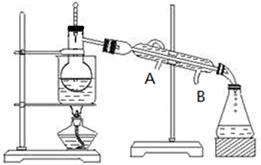
(10 分)结合下列实验装置图回答问题: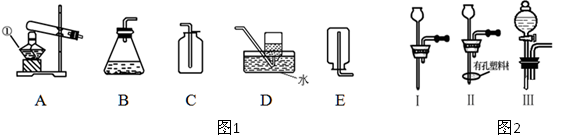
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是,收集装置是。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 Na2CO3 + H2O +CO2↑
Na2CO3 + H2O +CO2↑
NH4HCO3 NH3 ↑+ H2O +CO2↑
NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是。
他不选用碳酸氢铵制取CO2的理由是。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。