MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: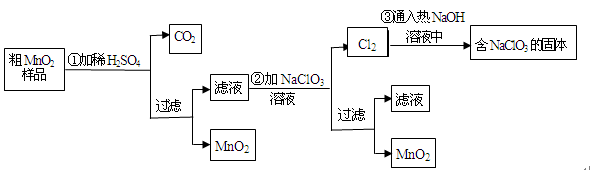
(1)第①步加稀H2SO4时,粗MnO2样品中的_________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:□ +□ +□ =□MnO2↓+□Cl2↑+□
+□ =□MnO2↓+□Cl2↑+□
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、________、________、________,
已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要________mol NaClO3。
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是。

(2)实验室常用如上图所示装置制取并收集氨气。
① 实验室制取氨气反应的化学方程式是。
② 图中方框内收集氨气的装置可选用(填字母序号)。
③ 尾气处理装置中使用倒扣漏斗的作用是。
(3)工业上用NH3制取NO反应的化学方程式是。
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.容量瓶洗涤后残留少量水不影响使用 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀。
(3)用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(保留到小数点后1位。),若实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
I.用下列仪器的编号回答问题:
①容量瓶 ②蒸馏烧瓶 ③量筒 ④烧杯 ⑤托盘天平 ⑥分液漏斗
(1)可加热的仪器且加热时必须垫石棉网的有;
(2)使用前必须检查是否漏水的有;
(3)仪器上标有零刻度的有。
II.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸盐。现从草木灰中提取钾盐,并用实验检验其中的 CO32-、 SO42-、 和 Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品;②溶解沉降;③;④;⑤冷却结晶。
(2)在进行上述②、③、④ 操作时,都要用到玻璃棒,其作用分别是:
② ;③ ;④ 。
(3)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成二份,分装在2支试管里。①在第一支试管里加入稀盐酸,可观察有生成,证明溶液中有离子。②在第二支试管里加入足量稀硝酸后,再加入足量Ba(NO3)2溶液,可观察到有生成,证明溶液中有离子。③将第二支试管反应后的溶液过滤,在滤液里加入AgNO3溶液,可观察到有生成,证明溶液中有离子。
(4)用托盘天平称量样品时,若指针偏向右边,则表示(填选项的标号)。
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻,样品重 |
(共8分)实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题: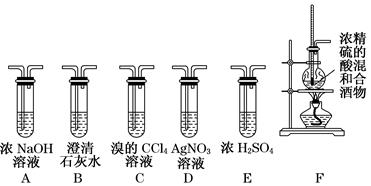
(1)写出实验室制备乙烯反应的化学方程式:,实验中,混合浓硫酸与乙醇的方法是将_____________慢慢加入另一种物质中;加热F装置时必须使液体温度___________(选填缓慢或迅速)升高到170℃,圆底烧瓶中加入几粒碎瓷片的作用是。
(2)为实现上述实验目的,装置的连接顺序为F→______________→D。(各装置限用一次)
(3)当C中观察到时,表明单质溴能与乙烯反应;若D中,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应。
阿司匹林的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式。
①分批用少量饱和NaHCO3溶解粗产品,目的是。判断该过程结束的方法是。
②滤液缓慢加入浓盐酸中,看到的现象是。
③检验最终产品中是否含有水杨酸的化学方法是。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
①写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式。
②阿司匹林药片中乙酰水杨酸质量分数的表达式为。