某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验,回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、______、 。
(2)实验开始后,写出B中反应的离子方程式_______________________。
(3)C中的现象是______________,E装置的作用是_____________________。
(4)某学生按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。请你计算原样品中Na2SO3的纯度为________(精确到0.1%)。
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将______(填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃___处酒精灯(填装置字母)。
某研究性学习小组利用如图所示装置完成有关实验。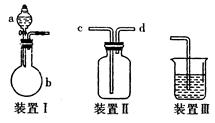
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入。装置Ⅱ从管口进气可作为氨气的收集装置。
【实验二】收集NO
(2)利用装置Ⅱ可收集NO,试简述操作方法:。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
| 装置序号 |
仪器中所加物质名称 |
现象 |
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
 |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
 |
Fe3+具有氧化性 |
实验结论:。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:。(填序号)
| A.Cl2 | B.Na | C.Na+ | D.Cl- E.SO2 F.NO2 |
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。
实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②100 mL量筒
③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)⑦滴定管
(1)配制时,必须使用的仪器有______ ______(填代号),还缺少的仪器是__
_。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为____________。
实验室需要450ml 0.12mol/L 的NaOH溶液,有如下操作:
的NaOH溶液,有如下操作:
①把称好的NaOH放入小烧杯中,加适量蒸馏水溶解
②根据计算用托盘天平称取NaOH 克
克
③把①所得溶液小心转 入一定容积的容量瓶中
入一定容积的容量瓶中
④继续向容量瓶中加蒸馏水至液面距刻度线1cm-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑥将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)、上述步骤中要称量的NaOH固体为克
(2)、操作步骤的正确顺序为(填序号)。
(3)、实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用mL(填序号)。
(4)、本实验用到的基本实验仪器除托盘天平, 药匙以外还有:。
药匙以外还有:。
(5)、误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)
②没有进行操作步骤⑤
③没有将溶解好的液体冷却就直接倒入容量瓶中
④容量瓶中原来有少量水
⑤某同学定容时仰视容量瓶刻度线
⑥定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切。
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:
(1)该实验中A部分的装置是(填写装置的序号)。
(2)请你设计一个实验 ,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式。
(4)该实验存在明显的缺陷,请你提出改进的方法。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI,反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为: