(15分)镁铝水滑石[Mg2Al(OH)6Cl·xH2O]在高温下完全分解,其分解方程式为:
2[Mg2Al(OH)6Cl·xH2O] 4MgO+Al2O3+2HCl↑+(5+2x)H2O↑
4MgO+Al2O3+2HCl↑+(5+2x)H2O↑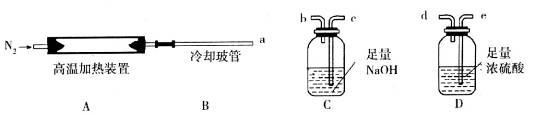
某化学小组现用下图装置进行实验确定其化学式(固定装置略去)。
(1)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为_______________(按气流方向,用接口字母表示)。装置连接后,首先要进行的操作是______________。
(2)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,仍需持续通入N2的作用是
①____________________________②_________________________________。
(3)完全分解后测得C增重3.65 g、D增重9.90 g,则x=_________________。若将通N2改为通干燥的空气,测定的x值将_________(填“偏高”或“偏低”)。
(4)该小组利用镁铝水滑石分解后剩余的固体来提取纯净氧化铝(冶炼铝的原料)。
请补充该小组设计的实验操作步骤
【实验中可选用的试剂:盐酸、氢氧化钠溶液、氨水、二氧化碳气体、蒸馏水】
①取分解后固体于烧杯中,加入足量的_____________,玻璃棒搅拌充分反应,过滤。
②______________________________________________,过滤,洗涤。
③加热
(5)下列实验能比较镁和铝的金属性强弱的是______________。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.分别向0.1mol·L-1AlCl3和0.1 mol·L-1MgCl2溶液中逐滴加过量NaOH溶液
d.测定等物质的量的镁和铝与足量盐酸反应生成的H2的多少
大家都知道6月1日是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”。20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的6月1日确定为“世界牛奶日”。人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca10(PO4)6(OH)2〕形式存在。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
| 纯牛奶 配料:鲜牛奶 保质期:8个月 净含量:250 mL/盒 营养成分(每100 mL) 钙≥0.11 g 脂肪≥3.3 g 蛋白质≥2.9 g |
(1)羟基磷酸钙中钙元素的质量分数为__________(保留到0.1 g)
(2)包装标签上脂肪≥3.3 g,是指100 mL牛奶中含脂肪至少3.3 g。那么一盒牛奶中含钙至少__________ g。(保留到0.01 g)
感冒是一种常见的病,人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。
(1)药物阿司匹林是一种传统的治疗感冒发烧的老药,从分子结构上看,它可以看作是乙酸酯,其结构简式如右图: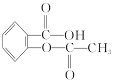
作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成_________和_________(用结构简式表示),阿司匹林分子水解后,能电离出氢离子(H+)的官能团增多,增大了对胃肠道的刺激。
(2)为减小副作用,一般宜饭后服药,并同时服用少量辅助药物,在①硫酸镁、②氢氧化钡、③碳酸钙中选取哪一种?
某学生欲测定味精中食盐的含量,做了如下实验:
①称取某牌号的袋装味精样品1.0 g;②将样品溶于适量蒸馏水中,加入足量用稀硝酸酸化的A溶液,充分反应,使沉淀完全;③过滤,并用蒸馏水洗涤沉淀多次;④将沉淀烘干称量,测得固体质量为0.50 g。
根据上述实验操作回答下列问题:
(1)加入的A溶液是__________;检验加入的A是否过量的方法是____________________。
(2)过滤时,为提高过滤效率,可用如右图所示的装置(称为抽滤装置)代替普通过滤装置,抽滤装置过滤速率比普通过滤装置快的主要原因是___________________________________。
(3)洗涤沉淀的方法____________________________________________________________。
(4)烘干沉淀应采用的方法是__________。
A.低温烘干 B.高温烘干 C.利用太阳能晒干
(5)该牌号味精中氯化钠的质量分数为__________,若该味精包装袋上标注“谷氨酸单钠含量≥80%,NaCl含量≤20%”,则此样品是否符合产品标示的质量分数__________(填“符合”或“不符合)。
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。
某学校化学科研小组对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数。
(2)实验试剂:水、AgNO3溶液等
(3)实验过程: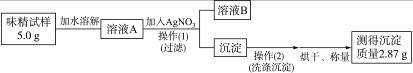
①操作(Ⅰ)所需要的玻璃仪器有____________________。
②通过计算判断该味精中NaCl的质量分数是__________,判断该味精中NaCl __________(填“符合”或“不符合”)其包装上标注的标准。
③若溶液A的体积为50 mL,则其中NaCl的物质的量浓度为____________________。
分别取1 mol葡萄糖进行下列实验:
(1)与银氨溶液发生银镜反应,能还原得到__________ mol银单质,反应后葡萄糖变为(结构简式)__________。
(2)与醋酸发生酯化反应,需__________ g醋酸才能完全酯化。
(3)若使之完全转化为H2O和CO2,所需O2的体积(标准状况)为__________ L。
(4)与新制Cu(OH)2悬浊液反应的化学方程式为_________________________________。