(1)常说的三大合成材料包括塑料、 和 。
(2)某些废弃的塑料通过分类、清洗、再加热熔融,可重新成为制品,这类塑料属于 (填“热塑性”或“热固性”)塑料。
(3)玻璃纤维增强塑料(玻璃钢)的基体是____________,增强剂是____________。
(4)CO中毒是因为CO与血红蛋白结合的能力远远大于______(填一种气体名称)与血红蛋白结合的能力,导致人窒息。
(5)下列属于塑料制品的是 (填序号),属于合成纤维的是______(填序号)
| A.聚乙烯制品 | B.汽车轮胎 | C.玻璃钢 | D.涤纶 E.羊毛 |
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是mol,燃烧产物的平均摩尔质量是g/mol。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液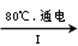 NaClO3溶液
NaClO3溶液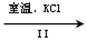 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□。
②Ⅱ中转化的基本反应类型是,该反应过程能析出KClO3晶体而无其它晶体析出的原因是。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。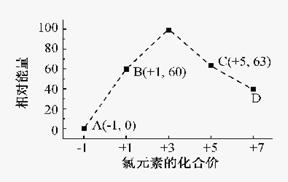
①D是(填离子符号)。
②B→A+C反应的离子方程式为;生成1molC时,KJ的热(填吸收或放出以及具体数值)
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。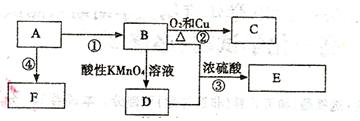
(1)A的结构简式为。
(2)D分子中的官能团是,
(3)写出下列反应的化学方程式
②④
酸奶中含有乳酸。乳酸在常温常压下是一种无色的黏度很大的液体。取9.0g乳酸与足量的Na反应,在标准状况下可收集到2.24L气体。另取9.0g乳酸与足量的NaHCO3反应,生成的CO2气体在标准状况下体积为2.24L。已知乳酸分子中含有一个甲基,则由上述条件可以确定
(1)乳酸的相对分子质量为。
(2)乳酸与NaHCO3反应的化学方程式为。
(3)在浓H2SO4存在下,两分子乳酸相互反应生成环状酯类化合物,环状酯的结构简式为。
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① |
||||||||
| ② |
③ |
④ |
||||||
| ⑤ |
⑥ |
⑦ |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答: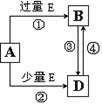
①E的电子式为。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为g。