KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4− +□C2O42−+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 |
60 s |
| 褪色后,再滴入第2滴 |
15 s |
| 褪色后,再滴入第3滴 |
3 s |
| 褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
全矾液流电池是一种新型电能储存和高效转化装置,其电解质溶液为VOSO4溶液,该电解质溶液可通过下列方法制取:将18.2gV2O5和30mL浓H2SO4加入到40mL水中,并在充分搅拌下在水浴上加热20min。向溶液中加水稀释至375mL,通SO2至悬浮液变成深蓝色溶液。将此溶液蒸发浓缩至原体积的五分之一,通入足量的CO2。再将溶液煮沸后,用稀释至1000mL,全矾液流电池的工作原理为VO2++H2O+V2+ 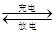 +V2++2H+。
+V2++2H+。
(1)通入SO2发生反应的化学方程式为。
(2)通入SO2的目的是。
(3)全矾液流电池充电时,阳极的电极反应式为。
(4)某溶液中含有VO2+、Cr2O32—,现向此溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+ →VO2+,Cr2O32—→ Cr3+。再滴入2.00mL,0.020mol/LKMnO2溶液,又恰好使VO2+ →VO2+,而Cr3+不变,试求溶液中Cr的质量(mg).
白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg(SiO10)(OH)3]来制取,其主要工艺流程如下: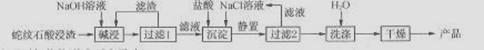
(1)蛇纹石用氧化物形式可表示为。
(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①;②(任举两种)。
(3)过滤1得到的滤液的主要成分是。
(4)沉淀时加入氯化钠溶液的作用可能是。
(5)洗涤时,如保证明产品已洗涤干净?。
I、磷、硫元素的单质和化合物应用广泛。
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO
每生成1mol P4时,就有__________mol电子发生转移。
(2)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:C6H8O6+I2 C6H6O6+2H++2I-2
C6H6O6+2H++2I-2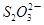 +I2
+I2
 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
(3)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2 +5
+5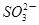 +2H+
+2H+ I2+5
I2+5 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: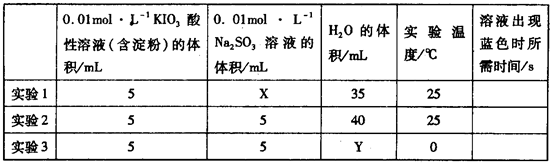
该实验的目的是______________;表中X=__________mL
Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(4)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是_______________________.
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式: Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1moleO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________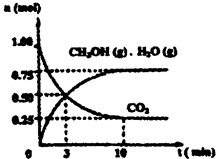
②下列措施中一定不能使CO2的转化率增大的是______________。
| A.在原容器中再充入lmolCO2 |
| B.在原容器中再充入1molH2 |
| C.在原容器中充入lmol氦气 |
| D.使用更有效的催化剂 |
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L
的NaOH溶液,所得溶液中离子浓度由大到小的顺序为
_______________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________(填“甲醇”或“氧气”),其电极上发生的电极反应式为____________。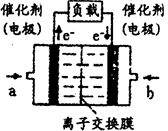
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。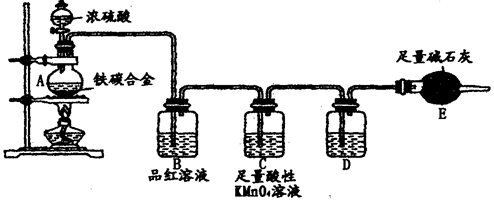
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B容器中均无明显现象,其原因是:___________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________、____________________。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_________________________(用含m、b的表达式表示)。
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是_________________。
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实
验测得合金中铁的质量分数也可能会偏高。你认为其中的原因
是__________________。
(8)某同学认为上述方法较复杂,使用下图所示的装置和其他
常用实验仪器测定某些数据即可。为了快速准确的计算出铁的
质量分数,最简便的实验操作是_____________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量