有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为 .
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 .
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 .
(4)Ⅳ中加NaClO的目的是 .
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).
防治环境污染,改善生态环境己成为全球的共识。
(1)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内。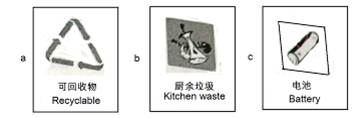
(2)工业废水需处理达标后才能排放。下列废水处理的方法合理的是(填字母)。
a.用中和法除去废水中的酸
b.用混凝法除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
d.用氧化还原法除油类、氰化物
(3)为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石。石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程式:。
某芳香烃A有如下转化关系: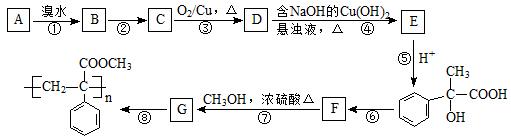
按要求填空:
⑴写出反应②和⑥的反应条件:②;⑥。
⑵写出A和G结构简式:A;G。
⑶写出反应③对应的化学方程式:;
⑷写出反应⑦对应的化学方程式:。
⑸属于取代反应的有(填序号),反应⑧的反应类型属于。
通过下列实验比较① ② CH3CH2OH ③ H-OH④
② CH3CH2OH ③ H-OH④
⑤ 五种物质中羟基上氢原子的活泼性顺序。在下表中填写实验现象及实验结论。
五种物质中羟基上氢原子的活泼性顺序。在下表中填写实验现象及实验结论。
| 编号 |
实验操作 |
实验现象 |
实验结论 |
| 1 |
分别取上述五种物质的少量溶液或液体于试管中,各滴入几滴石蕊试液 |
||
| 2 |
分别取适量①、⑤的水溶液,各加入少量NaHCO3固体 |
||
| 3 |
分别取少量②、③、④,各加入适量NaOH溶液,再通入足量CO2 |
||
| 4 |
分别取少量②、③的液体,各加入一小粒金属钠 |
结论:上述五种物质中的羟基上氢原子活泼性顺序为(填序号)
充分燃烧含C、H、O的一类有机物,消耗 O2的体积与生成 CO2的体积之比为9∶8(相同条件下)。
⑴该类有机物最简式是下列各类的(填字母)。
A、Cn(H2O)m B、(CO)n(H2O)m C、(C2H)n(H2O)m D、(C2O)n(H2O)m
⑵若符合该化合物通式的某有机物的分子量为136,则其分子式为:,若该有机物属于酯类且分子含有苯环,则其同分异构体除: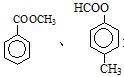 外还有:
外还有:
。
按要求完成下列问题
⑴用系统命名法命名下列有机物 ;
;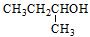 。
。
⑵ 的分子式。
的分子式。
⑶ 中含氧官能团的名称
中含氧官能团的名称 。
。
⑷相对分子质量为72且沸点最低的烷烃的结构简式。