某研究小组为测定某软锰矿中MnO2的质量分数,查阅资料获得如下信息:KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化,反应过程表示为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
小组成员采用滴定的方法测定软锰矿中MnO2的质量分数,设计实验如下:准确称取2.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到100mL容量瓶中并定容;从中分别取出20.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,记录最终读数。数据如下:
| 测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
| 初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
| 最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
试回答下列问题:
(1)0.0200mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;滴定终点如何判断 。
(2)你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果 (保留小数点后两位);若回答“否”,试说明原因 。
(3)若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗
Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
该反应中物质X应是 ________ ,b与c的关系是 ___________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: _________________。
②每生成1mol FeO42-转移 _______ mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_______________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______________(用含a、b的代数式表示)。
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH |
H2CO3 |
H2S |
H3PO4 |
| 1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=9.1×10-8 K2=1.1×10-12 |
K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是 ,最弱的是 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COO-、HCO3—、CO32—、S2-结合H+的能力由强到弱的顺序为 。
(4)在温度相同时,各弱酸的K值不同,K值越大酸越 (填“强”或 “弱”)。
(5)根据K值大小判断下列反应能否发生:CH3COOH + H2PO4- (填“能”或“不能”,下同) H2CO3 + HS-
(填“能”或“不能”,下同) H2CO3 + HS- 。
。

在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C. 正(H2)=
正(H2)= 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
下表中的数据是破坏1 mol物质的化学键所消耗的能量:
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题: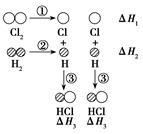
①ΔH1= kJ·mol-1,ΔH2= kJ·mol-1,ΔH3= kJ·mol-1。
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第 (填序号)步,请说明原因: 。
③该反应的热化学方程式为 。
某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)