(1)请用下列物质的序号填空:①NaF ②C2H4 ③Na2O2 ④Ba(OH)2 ⑤ CO2;只含有极性键的是 ,既有离子键又有非极性键的是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序是 。某氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
①写出基态Cu2+的核外电子排布式: ;在周期表中的位置是 。
②如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为 。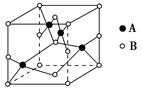
③CuO高温易转化为Cu2O,其原因是 。
按要求写出298K、101 kPa时下列反应的热化学方程式:
(1)3mol NO2(g)与1 mol H2O(1)反应生成HNO3(aq)和NO(g),放热138kJ:____________。
(2)1 mol HgO(s)分解为液态汞和氧气,吸热90.7kJ:___________________。
(3)①下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。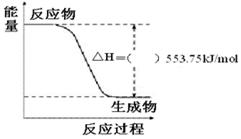
②写出表示丙烷燃烧热的热化学方程式:_______________________________________。
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表: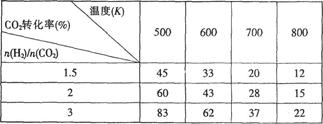
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)_________。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是___________。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)________25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___________________。
氯水中存在如下平衡:Cl2 +H2O ⇌ HCl+HClO。向氯水中加入下列物质,回答各问题:
(1)加入少量CaCO3(s),发生反应的离子方程式表示为__________________,平衡向________移动(填“正向”、“逆向”或“不”,下同),HClO的浓度______(填“增大”、“减小”或“不变”,下同)。
(2)加入少量NaCl(s),平衡向_________移动,HClO的浓度___________。
(3)加入少量NaOH(s),平衡向__________移动,HClO的浓度____________。
(4)加入少量NaBr溶液,发生反应的离子方程式表示为____,HCl的物质的量_____。
(5)加入少量浓品红试液,实验现象为_____________,HCl的物质的量___________。
(6)加蒸馏水稀释,HClO的浓度__________。
在物理和化学中,有些原理、定律具有相似性。如物理中有机械守恒定律,化学中有质量守恒定律。比较它们有助于我们的学习。
(1)1834年,物理学家楞次(1840年—1865年)概括了各种实验结果,得到如下结论:感应电流具有这样的方向,就是感应电流的磁场总要阻碍引起电流的磁通量变化。这就是楞次定律。请写出与楞次定律相似的化学原理或定律:______________________________;
其内容是_______________________________________________________________________
____________________________________________________________________________。
(2)在物理学的匀变速直线运动中常用图来分析速度、时间和位移相当于如图甲中阴影部分所占的面积。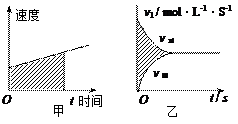
现在容积为2L的密闭容器中进行某一可逆反应: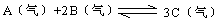 ,其中B物质的正反应速率
,其中B物质的正反应速率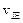 逆反应速率
逆反应速率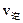 随时间变化的关系如右图乙所示,则图中阴影部分的面积表示的意义为:___________________
随时间变化的关系如右图乙所示,则图中阴影部分的面积表示的意义为:___________________