如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。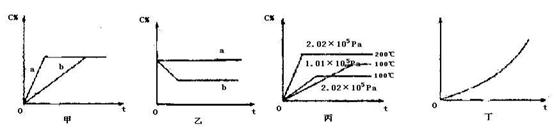
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况,速率:a b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则 曲线表示恒温恒容的情况,此时该恒温恒容中C% (填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是 反应(填:放热、吸热),计量数x的值是 ;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是 ,[填:①C% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为 。(填:左移或右移)
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。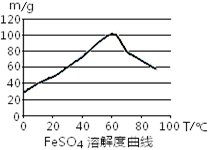
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为。若要提高FeSO4生成速率,采取下列措施中正确的是。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: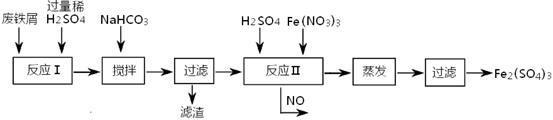
①加入NaHCO3并搅拌,将混合液pH调控至范围内,使杂质沉淀过滤除去。
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
4.7 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
6.7 |
②反应Ⅱ中反应的离子方程式是:。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是,气体X与NO配比的比例是。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。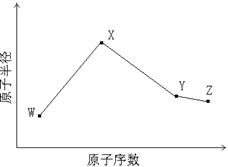
(1)Y在周期表中的位置是。
(2)用电子式解释X与W能形成化合物X3W的原因。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 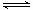 2A(g) △H =-92.4 kJ・mol―1
2A(g) △H =-92.4 kJ・mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mol/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10min |
3.8 |
8.4 |
0.4 |
| 第20min |
3.4 |
7.2 |
1.2 |
| 第30min |
3.4 |
7.2 |
1.2 |
| 第40min |
3.6 |
7.8 |
0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) =;
②反应在第10min改变了反应条件,改变的条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
已知:
I.
II.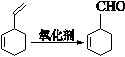
以1、3—丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
请回答:
(1)A的结构简式是;B的结构简式是。
(2)写出下列反应的化学方程式:
反应①,反应④。
某有机化合物经分析,含碳的质量分数为90%,含氢的质量分数为10% 其蒸气相对于氢气的密度为60,则:
I.有机物A的分子式为:
II.经红外光普测知A为苯的同系的,且核磁共振氢普峰面积比为3:2:2:2:3,则其结构简式为:
III.其有机物在一定条件下有下列转化关系如下:
请回答:
①.D中含氧官能团名称:
②.B→F的反应应类型,高分子化合物H的结构简式:
③.E→G的化学方程式:
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1K2(填“>”、“=”或“<”)
| T /K |
298 |
398 |
| 平衡常数K |
K1 |
K2 |
(3)下列各项能说明该反应达到平衡状态的是(填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为(填字母序号)
a.c(Cl-)﹥c(NH4+)b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断