某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。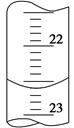
(4)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
(1)FeCl3的水溶液显________(“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;
(2)实验室配制FeCl3的溶液时,常将固体FeCl3先溶于_______中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干、灼烧,最后得到的主要产物是____________
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)________________________________;
(5)Al2S3为什么不能用Na2S溶液和AlCl3溶液制备(用离子方程式解释)__________________;
填空
(1).工业合成氨(化学方程式)____________________
(2).浓硝酸保存在棕色瓶中的原因,写出化学方程式__________________
(3).小苏打溶液中滴加氢氧化钠溶液(离子方程式)__________________
(4).汽车尾气中含有NO和CO,消除这两种物质对大气污染的方法是安装催化转化器,使他们发生反应生成无毒气体,该反应的化学方程式为__________________
(5).确定溶液中存在NH4+的方法(用文字叙述)______________________________。
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: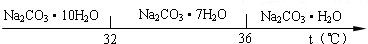
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下: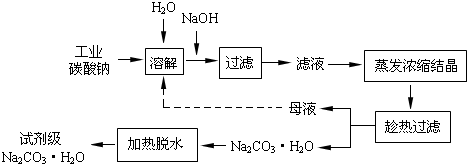
(1)加入NaOH溶液时,反应的离子方程式为__________________;
(2)向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= ___________;
(3)“母液”中除了含有Na+、CO32-外,还含有_________等离子。
(4)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行_________(填“可行”或“不可行”),并说明理由__________________;
(5)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g) △H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式__________________;
25℃,浓度都是1mol•L-1的四种正盐溶液,其pH情况如下:
| AX |
BX |
AY |
BY |
| pH=7,c(X-)=1mol/L |
pH=4 |
pH=6 |
(1)AY溶液pH__________7(填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX__________HY;若将等体积、等 pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH________BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=_______mol/L;
在AY溶液中:c(A+)-c(Y-)=_________(用一项表示)=_________(用两项表示);
(4)A2Z的水解方程式是_________;_________。
恒温恒容时在甲、乙、丙三个容器中均发生反应:2A+B 3C+2D,A、B、C、D均为气体,且正反应△H= -akJ·mol-1(a>0)。
3C+2D,A、B、C、D均为气体,且正反应△H= -akJ·mol-1(a>0)。
(1)甲、乙、丙三个容器中A的物质的量分别为2mol、1mol、2mol;B的物质的量分别为1mol、1mol、2mol;达到平衡后三个容器中B的转化率从大到小顺序为_____>_____>_____。
(2)现在一定条件下,于反应开始投入3.0molC和3.0molD,达平衡后A的体积分数为a%。其它条件不变是,若按下列四种配比作为起始物质,平衡后A的体积分数为a%的是_________;平衡后A的体积分数小于a%的是_________;平衡后A的体积分数大于a%的是_________;
A.4molA+2molA+2molA B.2molA+1molB+1molD C.2molA+1molB
(3)上题中三种选项为起始物质,达到新平衡时放出的热量A_______B;B______C;C_______a。