相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g),△H=-92.6 kJ·mol-1
2XY3(g),△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
【2015江苏化学】给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.粗硅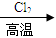 SiCl4 SiCl4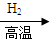 Si Si |
B.Mg(OH)2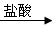 MgCl2(aq) MgCl2(aq) Mg Mg |
C.Fe2O3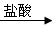 FeCl3(aq) FeCl3(aq)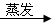 无水FeCl3 无水FeCl3 |
D.AgNO3(aq)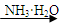 [Ag(NH3)2]OH(aq) [Ag(NH3)2]OH(aq)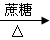 Ag Ag |
【2015海南化学】下列叙述正确的是
| A.稀盐酸可除去烧瓶内残留的MnO2 | B.可用磨口玻璃瓶保存NaOH溶液 |
| C.稀硝酸可除去试管内壁的银镜 | D.煮沸自来水可除去其中的Ca(HCO3)2 |
【2015海南化学】0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是
| A.NO2 | B.SO2 | C.SO3 | D.CO2 |
【2015广东理综化学】下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
分别加热Na2CO3和NaHCO3固体 |
试管内壁都有水珠 |
两种物质均受热分解 |
| B |
向稀的苯酚水溶液中滴加饱和溴水 |
生成白色沉淀 |
产物三溴苯酚不溶于水 |
| C |
向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 |
加入淀粉后溶液变成蓝色 |
氧化性:Cl2>I2 |
| D |
向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 |
加入H2O2后溶液变成血红色 |
Fe2+既有氧化性又有还原性 |
【2015安徽理综化学】下列有关说法正确的是
| A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 |
| B.Fe(OH)3胶体无色、透明,能发生丁达尔现象 |
| C.H2、SO2、CO2三种气体都可用浓硫酸干燥 |
| D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |