某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:
①取25.00mL工厂废水放入锥形瓶中,加入2~3滴甲基橙指示剂,用 0.2020mol·L-1氢氧化钠溶液滴至终点,滴定前后滴定管中示数如图。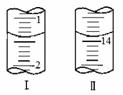
②再取25.00mL工厂废水放入锥形瓶中,加入 0.2020 mol·L-1NaOH溶液V1 mL(过量),振荡。然后加入2~3滴甲基橙试液,用0.1012mol·L-1的盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸V2mL。
③略。
(1)步骤①取25.00mL废水所用的仪器 ,滴定时左手 ,眼睛注视 。计算c(HCl)= mol·L-1。
(2)步骤②滴定至终点观察到的实验现象 。
步骤②测出氯化镁的浓度明显不合理,实验设计存在问题,请提出一种改进的方法 。
若改进后步骤②消耗盐酸的体积为V3mL。请列出计算c(MgCl2)的表达式 。
(3)请设计另外一种测定该工业废水各组分浓度的实验方案并简述实验步骤。
依据事实,写出下列反应的热化学方程式.
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O. 放出571.6kJ的热量,表示H2燃烧的热化学方程式为__________
(2)在25℃、101kPa下,1g甲醇(CH3OH)液体燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为______ _
(3)已知:已知:C(s)+O2(g)=CO2(g)△H=﹣437.3kJ•mol一1
H2(g)+ O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是_____ ____
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
请回答下列问题: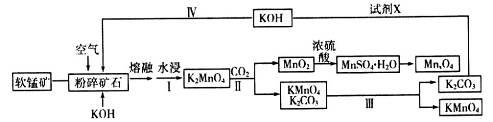
(1)K2MnO4中锰元素的化合价是___________。
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式___________________。
(3)分析下表数据。工业上采用III得到较纯净的高锰酸钾,III中包含的操作名称是________________。
(4)上述工业流程中试剂X的最佳物质是(填化学式)_________________________;设计步骤IV的目的是________________________。
(5)通过煅烧MnSO4·H2O可制得软磁铁氧体材料MnxO4。如图是煅烧MnSO4·H2O时温度与剩余固体质量变化的曲线。该曲线中A段所表示物质的化学式是_____________;MnxO4中x=_________________________。
许多含氯物质与生活密切相关,如HClO、ClO2、NaClO2等都是重要的杀菌消毒剂和漂白剂。其中制备NaClO2的工业流程下图所示: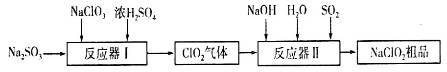
请回答下列问题:
(1)反应器I中反应的氧化剂是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为_________________________________。
(3)通入反应器Ⅱ中的SO2能用H2O2代替,请简要说明理由____________________。
(4)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL,溶液于锥形瓶中,再加入足量酸化的KI溶液。充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液漓定,达到滴定达终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度___________。(提示:2Na2S2O3+I2====Na2S4O6+2NaI)
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。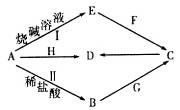
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。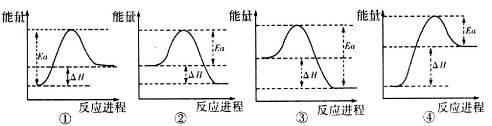
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。