X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Z元素位于周期表第_____周期,第 族。Z单质与水反应的离子方程式为
(2)由、X、Y、Z三种元素组成的化合物中,含有的化学键类型有 (填字母)
A.离子键 B.极性共价键 C.非极性共价键
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 (填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的Na OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)原NaO H溶液的质量分数为________。
H溶液的质量分数为________。
(2)所得溶液中Cl-的物质的量为________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液是无色的,请回答:
(1)D的化学式是是________,画出B元素原子结构示意图__________。
(2)反应④的化学方程式为____________________。
(3)现有12mol/L的E溶液, 要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。
要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。
有一包白色固体,可能含有Na2CO3、KNO3、NaCl、BaCl2和CuSO4,按下列步骤做实验。
①将该固体溶于水只得到无色溶液。②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。
根据上述现象判断:(1)一定存在的物质是____________,一定不存在的物质是____________。(2)可能存在的物质是____________,可以采用__________实验确定其存在。
电解饱和食盐水装置的结构如图所示: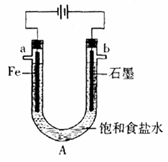
(1)写出电解食盐水的化学方程式
(2)滴入酚酞显红色的是极(填a或b,下同),___极产生的气体可使湿润的淀粉碘化钾试纸变蓝。
(3)工业上可以用生产的氯气制备漂白粉,该反应的化学方程式
在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为,,。