氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)写出电解饱和食盐水的化学方程式 。
(2)如果粗盐中SO 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO ,该钡试剂可以是 (选填A、B、C,多选扣分)
,该钡试剂可以是 (选填A、B、C,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)判断钡试剂已经过量的方法是 。
(4)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为 (选填A,B,C多选扣分)
,加入试剂的合理顺序为 (选填A,B,C多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(5)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,
图中的错误是 。
关于该配制过程中,下列说法正确的是________。
A.应称取氯化钠晶体的质量为1.755 g
B.洗涤液不需要转移到容量瓶中
C.定容时,由于同学仰视,将导致所配溶液浓度偏低
D.摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。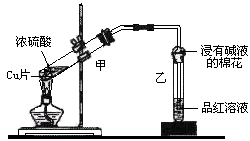
请回答下列问题:
(1)通过试管乙中发生的现象说明了铜和浓硫酸发生了化学反应。
(2)试管乙口部浸有碱液的棉花的作用是,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)、(填“有”或“无”)毒气体。
(3)写出试管甲中所发生反应的化学反应方程式。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水1 L,加入0.5 mol ·L—1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:该1 L雨水中共溶解的SO2体积是mL(标准状况)。
间硝基苯胺(Mr=128)是一种重要的染料中间体。它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇。间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下:
已知:R-NH2 + H+ → R-NH3+
实验步骤:
①在100mL锥形瓶中加入8g结晶硫化钠与30mL水,搅拌溶解。再加入2g硫黄粉,缓缓加热并不断搅拌到硫黄粉全部溶解,冷却后备用。
②在150mL三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,安装机械搅拌装置、滴液漏斗和回流冷凝管如图所示,将步骤①配制的多硫化钠溶液加入滴液漏斗。
③加热三颈烧瓶至瓶内微微沸腾,开动搅拌使间二硝基苯与水形成悬浮液。慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min。移去热源,用冷水浴使反应物迅速冷却到室温后,减压过滤,滤饼洗涤三次。
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并用玻璃棒搅拌,使间硝基苯胺溶解,冷却到室温后减压过滤。
⑤冷却滤液,在搅拌下滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺。
⑥冷却到室温后减压过滤,洗涤滤饼到中性,抽干,产物重结晶提纯,在红外灯下干燥,称重,得2.56g。
回答下列问题:
(1)滴液漏斗较普通分液漏斗的优点;第④步中配制稀盐酸的容器名称为。
(2)间二硝基苯和间硝基苯胺都有毒,因此该实验应在内进行。
(3)在铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物)也可以将硝基还原为氨基,却未被采用,其可能原因为。
(4)第④步用盐酸溶解粗产品,而不用水的原因。
(5)第③步中滤饼洗涤三次,可选用的洗涤剂为();第⑥步产物要进行重结晶,可选用的试剂为()。
| A.冷水 | B.热水 | C.乙醚 | D.乙醇 |
(6)第③步中,搅拌使间二硝基苯与水形成悬浮液后再滴加多硫化钠溶液,其原因为。
(7)第⑥步中要将滤饼洗涤到中性,检验方法为。
(8)该反应的产率为。
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中A仪器的名称为:,
D装置在实验中的作用是。
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为,
C中发生反应的化学方程式为:。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被氧化为HIO3,写出该反应的化学方程式。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是,C中发生反应的离子方程式为:。
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是__________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有 ____________________。
(3)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_________________________。
(6)将等体积的AlCl3与NaOH溶液混合,充分反应后,测得混合溶液中含有铝元素质量为沉淀中含有铝元素质量的2倍,则c(AlCl3)与c(NaOH)的比值是___________
(15分)环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣小组尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置图如下:
环己酮为无色或浅黄色透明液体,有强烈的刺激性臭味,密度为0.95 g/mL,熔点为—45 ℃,沸点为155 ℃,溶解度(100 mL H2O)为2.4 g (31 ℃)。

回答下列问题:
(1)在反应开始的前5min内,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有。
(2)加入饱和NaHSO3溶液时发生的主要反应是。(用离子方程式表示);确保加入的饱和NaHSO3溶液已经足量,可以取少量烧瓶中的液体,加入(填写应该加入的试剂),若看到,则说明NaHSO3溶液足量。
(3)为将馏出液的pH调至中性,可以加入的试剂是。
| A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
(4)调节pH后还需加入精制食盐,其目的是,“取有机层”时使用的主要仪器是(填下图对应的字母)。