以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH见右表。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是 。
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出离子方程式: 。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出总反应的离子方程式: 。
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为 ≤pH< 。
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示): 。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中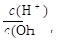 =;
=;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是。
(11分) (1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25oC,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如右图。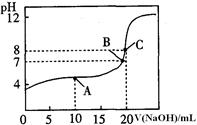
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是点对应的溶液;
③25OC,HA的电离平衡常数约为。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_____(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1molClO2,则转移电子的物质的量为_________0.1
mol。
(2)目前已开发出用电解法制取ClO2的新工艺。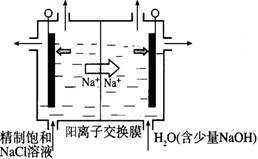
①右图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因________________。
(3)ClO2对污水中Fe2+、Mn2+、S2–和CN–等有明显的去除效果。某工厂污水中含CN– a mg/L,现用ClO2将CN–氧化,只生成两种气体,其离子反应方程式为;处理100 m3这种污水,至少需要ClO2 _______ mol。
能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。
(1)已知:在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。
请写出甲醇燃烧的热化学方程式。
(2)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇: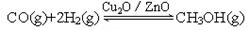 甲醇的物质的量与反应温度的关系如右图所示:
甲醇的物质的量与反应温度的关系如右图所示: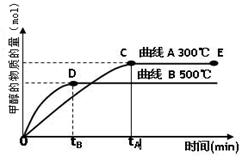 、
、
①合成甲醇反应的△H______0。(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率____________。(填“加快”、“减慢”、“不变”),重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1。若其它条件不变,将温度升高到450℃时,达到平衡时,K1(填“>、< 或 = ”)
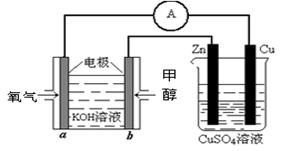
(3)利用甲醇燃料电池设计如右图所示的装置:则该装置中Zn极为极;写出a极的电极反应式
。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式;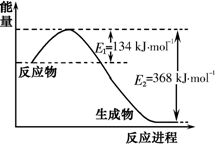
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L–1)2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”);
②判断该反应达到化学平衡状态的依据是(填序号);
A.2υ(H2)(正=3υ(NH3)(逆)B.2υ(N2)(正=υ(H2)(逆)
C.容器内压强保持不变D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。(肼的分子式为N2H4)
①写出盐酸肼第一步水解反应的离子方程式;
②盐酸肼水溶液中离子浓度关系正确的是(填序号)。
A.c(Cl–)>c(N2H62+)>c(H+)>c(OH–)
B.c(Cl–)>c( [N2H5·H2O+])>c(H+)>c(OH–)
C.2 c(N2H62+)+ c ([N2H5·H2O +])+c(H+)=c(OH–)
D.c(N2H62+)>c(Cl–)>c(H+)>c(OH–)