控制适合的条件,将反应Fe3++Ag⇌Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是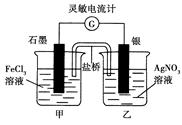
| A.盐桥中的K+移向乙烧杯 |
| B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| C.在外电路中,电子从石墨电极流向银电极 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
下列关于有机物的说法中,不正确的是()
| A.糖类、油脂和蛋白质在一定条件下都能发生水解反应 |
| B.2,5一二甲基己烷的核磁共振氢谱中会出现三组峰 |
| C.甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| D.分子式为C5H12的有机物只有三种,它们属于同分异构体 |
下述实验不能达到预期目的的是()
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
| B |
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 |
比较氯与溴的氧化性强弱 |
| C |
将铜片分别与浓、稀硝酸反应 |
探究浓、稀硝酸氧化性的相对强弱 |
| D |
向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌。 |
探究浓硫酸的脱水性 |
下列溶液中有关物质的量浓度关系和计算不正确的是()
| A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3) <c(CH3COONa) |
B.已知25°C时 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 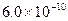 mol·L-1 mol·L-1 |
| C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶 液中水电离出来的OH-浓度 |
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有 |
下列有关结构和性质的说法中,正确的是()
| A.元素非金属性Cl>S的实验依据是酸性HCl>H2S |
| B.碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 |
| C.同周期主族元素的原子形成的简单离子的电子层结构一定相同 |
| D.Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
设阿伏加德罗常数为NA。则下列说法正确的是()
| A.7.1g Cl2与足量NaOH溶液充分反应后,转移的电子数为O.1 NA |
| B.1.0L浓度为1.0 mol·L-1的一元酸溶液中含有的氢离子数为1.0 NA |
| C.常温下,1L 0.1 mo1.L-1的NH4NO2溶液中氮原子数小于0.2 NA |
| D.标准状况下,22.4L乙醛中含有的氧原子数为1.0 NA |