NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容。
(1)请写出实验室制取NH3的化学方程式 ;
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因
(用离子方程式和简要的文字说明);
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的_________,若外界条件为标准状况,所得氨水的物质的量浓度为________;
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理。设计成NH3—O2燃料电池,碱性条件下该电池负极电极反应为: 。
(1)写出电子式: KCl; CO2
(2)用电子式表示下列化合物的形成过程: CaF2: NH3:
(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法 如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是
;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
(10分)有10 mL NaOH溶液,向其中通人一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液。向所得溶液中逐滴加入0.1 mol/L的盐酸,边加边振荡。使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如下图所示。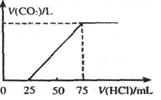
请回答下列问题:
(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸时发生反应的离子方程式为 、。
(2)混合溶液中Na2CO3和NaHCO3的物质的量之比为。
(3)原NaOH溶液中NaOH的物质的量浓度为,所通CO 2气体的体积在标准状况下为。
2气体的体积在标准状况下为。
(4)a mL同浓度的NaOH溶液,与足量的CO2发生反应,得到的溶液中所含溶质的最大质量为(用含a的数学 式表示)。
式表示)。
汞单质及其化合物在工业生产和科学实验中有广泛的用途,汞的矿源是朱砂(HgS)。朱砂炼汞的反应之一为(在加热条件下进行):HgS + O2 =" Hg" + SO2
请回答:
HgS与O2的反应中,氧化剂是,每生成1molHg转移电子的物质的量为
中学化学中几种常见物质的转化关系如下图(有部分产物未画出)。A是一种金属单质,D是一种非金属固体单质。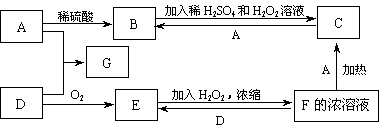
回答下列问题:
(1)A是 G是
(2)请写出鉴定B中阳离子的实验方法和现象
(3)在酸性条件下,再举出可使B转化为C的两种试剂
(4)写出反应C+A→B的离子方程式:
(5)写出反应E+H2O2→F的化学方程式: