亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
(1)如图为常见仪器的部分结构: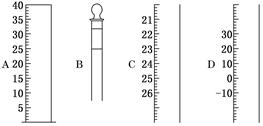
请写出仪器名称:
A________,B________,C________,D________。
(2)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体)________。
②容量瓶________。
③酸式滴定管________。
④集气瓶(收集HCl气体)________。
(10分)甲、乙两人分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸.
(1)甲:量取20 mL 18 mol/L浓硫酸,小心地倒入盛有少量水的烧瓶中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入水至刻线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有__________________________。
②将溶液转移到容量瓶中的正确操作是________________________________。
③定容的正确操作是_________________________________________。
(2)乙:用100 mL量筒量取20 mL 18 mol/L浓硫酸,并向其中小心地加入少量水,搅拌均匀,等冷却至室温后,再加入水至100 mL刻线,再搅拌均匀.你认为此法是否正确?若不正确,指出其中错误之处_________。
(8分)下面a~f是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.托盘天平 d.温度计 e.分液漏斗
(1)标出仪器使用温度的是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________ g。
(4)配制2 mol·L-1 H2SO4时,用a量取浓H2SO4时视线高于液面,则配得的浓度(偏高、偏低或无影响)
如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: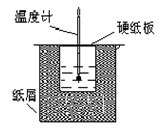
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)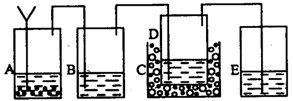
(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?