某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
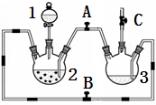
(1)稀硫酸应放在 中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色为 。试分析实验开始时排尽装置中空气的理由 。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是 。
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗高锰酸钾溶液体积/mL |
25.52 |
25.02 |
24.98 |
滴定过程中发生反应的离子方程式为 。滴定终点的现象是 。
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因(填序号):
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |
(2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是:;验证方法是:。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是:。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:
试回答下列问题:
①试剂1是,试剂2是。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?。若你认为不合理,请提出你的猜想,并设计一个简单的实验加以验证(若你认为合理,该空不要作答)。
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸氨,再经过再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大()
| A.凯氏烧瓶中溶液转移移到容量瓶中时,未洗涤凯氏烧瓶 |
| B.定容时,俯视刻度线 |
C.定容时,仰视刻度线 |
| D.移液时,有少量液体溅出 |
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为。 已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7 + 2HCl + 5H2O = 2NH4Cl + 4H3BO3。
已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7 + 2HCl + 5H2O = 2NH4Cl + 4H3BO3。
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为。
某同学设计了如下装置用于制取SO2和验证SO2的性质。分流漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3。试回答以下问题:
⑴锥形瓶内发生的反应的化学方程式为:。
⑵实验过程中,品红试液的颜色变为:;石蕊试液的颜色变化为:。实验后加热烧瓶,品红试液的颜色变化为:。
⑶溴水与SO2反应的离子方程式为:。
⑷导管①的作用是:;倒置漏斗的作用是。
⑸方框内装置能否换成启普发生器?(回答“能”或“不能”)。
 某研究性小组借助
-
的仪器装置完成有关实验
某研究性小组借助
-
的仪器装置完成有关实验


【实验一】收集
气体。
(1)用装置
收集
气体,正确的操作上(填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】为了探究镀锌薄铁板上的锌的质量分数
和镀层厚度,查询得知锌易溶于碱:
↑据此,截取面积为
的双面镀锌薄铁板试样,剪碎、称得质量为
。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
【实验二】为了探究镀锌薄铁板上的锌的质量分数
和镀层厚度,查询得知锌易溶于碱:
↑据此,截取面积为
的双面镀锌薄铁板试样,剪碎、称得质量为
。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。 (2)选用
和(填仪器标号)两个装置进行实验。
(2)选用
和(填仪器标号)两个装置进行实验。 (3)测得充分反应后生成氢气的体积为
(标准状况),
=。
(3)测得充分反应后生成氢气的体积为
(标准状况),
=。 (4)计算镀层厚度,还需要检索的一个物理量是。
(4)计算镀层厚度,还需要检索的一个物理量是。 (5)若装置
中的恒压分液漏斗改为普通分液漏斗,测量结果将(填"偏大"、"偏小"或"无影响")。
(5)若装置
中的恒压分液漏斗改为普通分液漏斗,测量结果将(填"偏大"、"偏小"或"无影响")。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器
做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为
。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器
做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为
。 (6)
。
(6)
。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为
的质量)实现探究目标。实验同样使用仪器
。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为
的质量)实现探究目标。实验同样使用仪器
。 (7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
(7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
 从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:
从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:


请回答下列问题: (1)流程甲加入盐酸后生成
的方程式为.
(1)流程甲加入盐酸后生成
的方程式为. (2)流程乙加入烧碱后生成
的离子方程式为.
(2)流程乙加入烧碱后生成
的离子方程式为. (3)验证滤液
含
,可取少量滤液并加入填试剂名称)。
(3)验证滤液
含
,可取少量滤液并加入填试剂名称)。 (4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_
(4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_ (5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
(5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.