(本题6分)依据某氧化还原反应设计的原电池如图所示。
(1)该氧化还原反应的离子方程式为_________________________________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出铜片和银片洗净干燥后称重,总质量为67.6g,请计算:通过导线的电子的物质的量。(要求有计算过程)
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________%。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是 ___ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是_______(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________。
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 |
待测液(mL) |
0.6000mol/L盐酸溶液的体积(mL) |
|
| 初读数 |
终读数 |
||
| 第一次 |
20.00 |
1.00 |
21.00 |
| 第二次 |
20.00 |
如右图Ⅰ |
如右图Ⅱ |
①第二次滴定,从图Ⅰ图Ⅱ 显示消耗的盐酸溶液体积为。
显示消耗的盐酸溶液体积为。
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=。
③该同学测定结果有一定的误差,产生该误差的原因可能是(选填编号)。
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C(s)+H2O(g)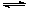 CO(g)+H2(g)−131.4 kJ。
CO(g)+H2(g)−131.4 kJ。
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5miin的平均反应速率为_________________________。
(2)能说明该反应已达到平衡状态的是________(选填编号)。
a.v正 (C)= v逆(H2O)b.容器中CO的体积分数保持不变
c.c(H2)=c(CO) d.炭的质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化: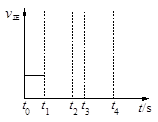
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2经如下两步反应制得甲酸甲酯:
①CO(g) + 2H2(g)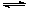 CH3OH(g)②CO(g) + CH3OH(g)
CH3OH(g)②CO(g) + CH3OH(g)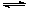 HCOOCH3(g)
HCOOCH3(g)
①反应①中CO的平衡转化率(α)与温度、压强的关系如图所示。在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是。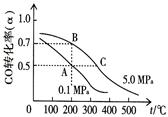
②已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则5.04kgCO最多可制得甲酸甲酯kg。
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是。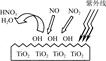
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____
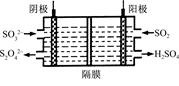
(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条): ______。
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为;与其同周期相邻且单质为固体的元素原子的核外电子排布式为。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为(用离子符号表示),其中形成的化合物中能发生潮解的是(用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式:。
②Be(OH)+与强碱溶液反应的离子方程式:。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是(选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气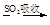

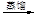 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳
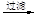
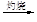 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液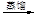 碘晶体
碘晶体
d.海盐提纯:海盐
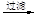
 精盐
精盐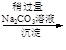
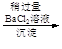
 滤液
滤液
 食盐晶体
食盐晶体
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。