(12分)有四种常见药物:①阿司匹林;②青霉素;③胃舒平;④麻黄碱。请回答下列问题(填序号)。
(1)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是______;
(2)某同学胃酸过多,应选用的药物是______,
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是______;
(4)滥用药物会导致不良后果,如过量服用引起中毒,应立即停药,并静脉注射NaHCO3溶液的是______。
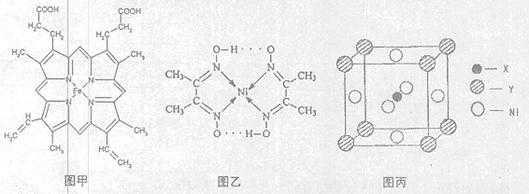
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是,根据以上电负性请判断H2N—CHO中C和N的化合价分别为和。基态Fe原子的核外电子排布式为。血红素中两种N原子的杂化方式分别为、。
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。Cl2、IBr、ICl沸点由高到低的顺序为。I+3(可看成H+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为。多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为。①HClO4、②HIO4、③H2CIO6的酸性由强到弱的顺序为(填序号)。
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于晶体。如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是(填字母编号)。
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性。X元素原子的2p能级的电子排布图为 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为。
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为。
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在的郊区。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)写出沸腾炉内煅烧黄铁矿的化学方程式:;
写出接触室中的化学 方程式:。
方程式:。
(3)CuFeS2是黄铜矿的主要成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为。
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是。
A.黄铁计煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)下表是压强对SO2平衡转化率的影响: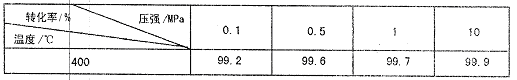
对于SO2转化为SO3的反应,增大压强可使转化率,但在实际工业生产中常采用常压条件,理由是。
(6)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化见下表:
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 炉渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因:。
现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因。
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH、H2的燃烧热分别为—726.5kJ/mol、—285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式:。
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为___。溶液中的阴离子向极定向移动。
(3)如图是一个电化学装置示意图,用CH3OH—空气燃料电池作此装置的电源。
①如果A为粗铜,B为纯铜,C为CuSO4溶液。该原理的工业生产意义是。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液。通电后,
若B极增重10.8 g,该燃料电池理论上消耗____mol甲醇。(计算结果保留两位有效数字)
(4)常温下向1L、0.2 mol/L NaOH溶液中通入4.48 L(标准状况)的
SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32—)_c(H2SO3)(填“>”、“<”、或“=”)。有关该溶液中离子浓度关系的判断正确的是(填字母编号)。
A.c(S O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) |
| B.c(H2SO3)+c(HSO3—)+c(SO32—)=" 0.2" mol/L |
| C.c(H2SO3)+c(H+)=c(SO32—)十c(OH-) |
| D.c(Na+)>c(H+)>c(HSO3—)>c(OH—) |
已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是,F的电子式是。
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的
化学方程式:。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8 mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4 mol/L,此时反应v正v逆(填“>”、“<”或“=”)。 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度(填“增大”、“不变”或“减小”),B的转化率
_。(填“升高”、“不变”或“降低”),L的体积分数(填“增大”、“不变”、“减小”或“无法确定”)。
某种医药中间体G,常用来制备抗凝血药,其结构简式是: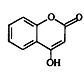 。
。
(1)G中含氧官能团是。
(2)下列关于G的说法正确的是。
a.能与溴单质反应b.能与金属钠反应
c.1 molG最多能和3 mol氢气反应 d.分子式是C9H7O3
可通过下列路线合成此医药中间体:
请回答下列问题:
(3)A与银氨溶液反应有银镜生成,则A的结构简式是;B→C的反应类型是 。
。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)E的结构简式是;与D互为同分异构体且含苯环、属于酯类的有机物有种。