A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: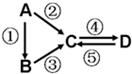
(1)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写③反应的化学方程式_____________________________。
(2)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写④反应离子方程式 。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素均为同一主族,且溶液均显碱性。写出②反应的化学方程式 。
(4)若A是当今应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式 。
(10分)“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO
和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向进行(填“左”或“右”),判断依据是。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。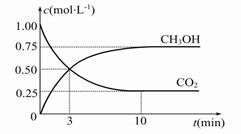
①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②反应达到平衡后,下列措施能使[CH3OH]∕[CO2]增大的是(填符号)。
| A.升高温度 |
| B.再充入H2 |
| C.再充入CO2 |
| D.将H2O(g)从体系中分离 |
E.充入He(g)
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
又知:H2O(l) H2O(g)ΔH=" +" 44.0 kJ/mol
H2O(g)ΔH=" +" 44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH=kJ/mol,该反应的化学平衡常数表达式为K=,控制其他条件不变,增大压强,K值(填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH=kJ/mol,该反应的化学平衡常数表达式为K=,控制其他条件不变,增大压强,K值(填“增大”、“减小”或“不变”)。
(12分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
①0~4 min时间段平均反应速率v(CO)=mol·L-1·min-1。
②在800℃时该反应的化学平衡常数K=(要求写出表达式及数值),CO的转化率=。
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol·L-1和0.80 mol·L-1,则达到平衡时CO转化为CO2的转化率是。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)  CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K=,△H0(填“>”、“<”或“=”)。
②300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,
对平衡体系产生的影响是(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
③其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成250℃、350℃时H2的转化率随时间的变化示意图。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g)ΔH =-b kJ·mol-1
③ H2O(g)= H2O(l)ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l)ΔH=kJ·mol-1。
计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb。