计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb 。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb 。
胃舒平(主要成分为Al(OH)3)能够治疗胃酸过多,反应的化学方程式是
_________________________________________。
中国卫生部部长陈竺表示,中国甲型H1N1流感疫苗接种方案的原则已经确立:要首先保护最为易感和脆弱的人群,特别是中学生、有基础性疾病(如糖尿病)的人、一线的公共服务人员。请根据这一主题和题意回答下列问题。(用下列选项的字母代号填空)
| A.蛋白质 |
| B.强氧化性 |
| C.葡萄糖 |
| D.变性 |
E.强酸性
F.淀粉
G.盐析
H.强还原性
(1)糖尿病是因为病人的尿液中含而得名的。
(2)甲型H1N1流感病毒和疫苗都含有。
(3)为预防甲型H1Nl流感.可用具有的NaClO溶液进行环境消毒。
(4)烹制猪肉时温度达到71℃,就可杀死细菌和病毒。这是因为细菌和病毒发生了。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。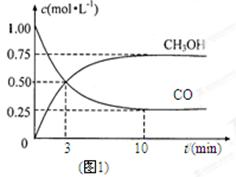
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=; H2的平衡转化率为_________________________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式。
(3)该温度下,反应平衡常数K=______(填数值)。
(4)恒容条件下,下列措施中能使反应体系中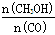 增大的措施有。
增大的措施有。
| A.升高温度 | B.充入He气 |
| C.再充入2 molH2 | D.使用催化剂 |
以下是某实验小组用工业硫酸铜(含硫酸亚铁等杂质)进行提纯实验,得到纯净硫酸铜晶体的流程:(已知数据:lg2=0.3;lg5=0.7)
请回答下列问题:
(1)①步骤I的目的是除不溶性杂质。操作是。
②步骤Ⅱ是为了除去Fe2+,常加入氧化剂使Fe2+氧化为Fe3+,下列物质最适合的是________。
A.KMnO4B.H2O2C.Cl2水D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu
(2)已知常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,分别写出Cu(OH)2开始沉淀时溶液的pH=________并写出步骤Ⅱ调节溶液pH的合理范围______。
(10分)化工厂生产的某产品只含C、H、O三种元素,分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。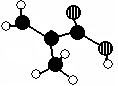
(1)该产品的结构简式为_______,所含官能团的名称:_____________
(2)该有机物的核磁共振氢谱上有________个峰(信号)
(3)下列物质中,与该产品互为同分异构体的是_____________(填序号,下同)与该产品互为同系物的是_____________。
①CH3CH=CHCOOH②CH2=CHCOOCH3 ③CH3CH2CH="CHCOOH" ④CH3CH(CH3)COOH