某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是______。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是__________。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和_____的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。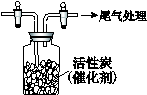
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,证明无色液体是SO2Cl2。
①写出SO2Cl2与H2O反应的化学方程式_____。
②检验该溶液中Cl-的方法是______。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
① 该白色沉淀的成分是______。
② 写出SO2与Cl2反应的化学方程式____________ ,并阐述理由______。
氨气是重要的化工原料。
38.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气,。
39.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧b.含碳物质燃烧 c.合成氨厂的副产品
40.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;
②[Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因。
41.某实验小组设计了下列装置进行氨的催化氧化实验。

(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为:、。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOHg。
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因:、。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明;②实验III的目的是。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ①mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ②。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
配制混酸的方法是_____ ___。
反应中需不断搅拌,目的是_________________________________________________。
(2)仪器A的名称是________,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:
其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
反应试剂、产物的物理常数:
| 名称 |
相对分 子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下: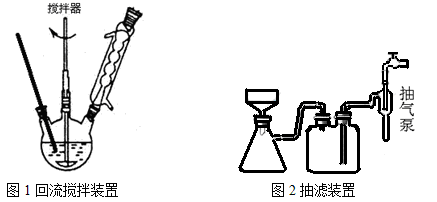
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)无色液体A的结构简式为。操作Ⅱ为。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是。
(3)下列关于仪器的组装或者使用正确的是。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入,分液,水层再加入,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为。
(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: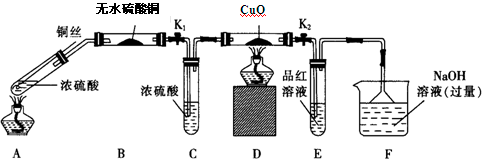
(1)F装置的烧杯中发生反应的离子方程式是;B装置中的现象是。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+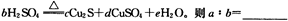
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol·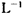 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为。
(已知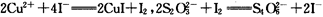 )
)