(1)请根据官能团的不同对下列有机物进行分类:
①(CH3)3CCH2OH ②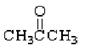 ③
③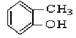
④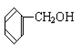 ⑤
⑤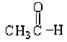 ⑥
⑥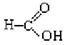
上述物质中,属于芳香醇的是 ,属于酚类的是 属于羧酸类的是 ,属于醛类的是 (填序号)
(2)下列属于同系物的是 ,属于同分异构体的是 (填入编号)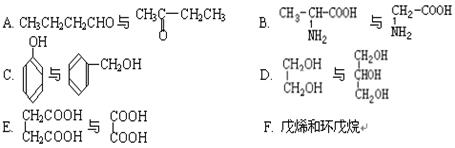
.有机物A  是合
是合 成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
(1)有机物A能够发生的反应有:(填写字母)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应
(2)有机物A在Cu做催化剂和加热条件下,与足量氧气充分反应生成有机物B。写出A→B的化学方程式。
(3)有机物B经氧化后生成有机物C,C可有如下图所示的转化关系: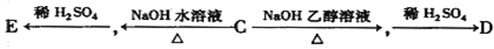
写出E的结构简式:;
(4)D在高温、高压和催化剂作用下反应生成HPMA,写出反应的化学方程式:
(5)F是E的一种同分异构体。0.1mol F与足量金属Na反应放出3.36L H2(标准状况下);0.1mol E与足量NaHCO3反应放出2.24LCO2(标准状况下);则F中含有的官能团的名称是,F能发生银镜反应。F的结构简式可能是:_、。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空: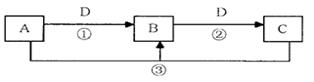
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干棕黄色的B的溶液不
能得到B,则B的化学式可能是________。用有关离子方程式解释 B溶液显酸性的原因是:;
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为;
(3)若 D的氯碱
D的氯碱 工
工 业的主要产品,B有两性,则反应③的离子方程式是;
业的主要产品,B有两性,则反应③的离子方程式是;
(4)若D为酸或酸性气体,则A、C可以是,;
(5)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为。
X、Y、Z、W是周期表中原子序数依次增大的前20号元素。X、Y同周期。Y、Z同主族,Zn-与Wn+离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D是由元素W、Y形成的常见化合物。
(1)元素W的名称,A的电子式,Wn+离子的结构示意图为,F晶体中含有的化学键类型。
(2)写出D、E的化学式:D、E 。
(3)F与水反应的化学方程式:。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的2倍。这四种元素的单质中常温下有 两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
⑴写出元素符号:A B C D  。
。
⑵写出两种均含A、B、C、D四种元素的化合物相互反应放出气体的化学方程式:
。
⑶用电子式表示化合物C2D形成过程  。
。
⑷用A和B两元素的单质可以制成燃料电池,电池中装有浓KOH溶液。用多孔 的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
(10分) 为了防止铁被腐蚀,常在铁皮表面镀上一层较耐腐蚀的金属,如镀锌铁和镀锡铁,若罐头欲装蕃茄酱,该罐头的材料应选用上述的铁。各取一小块镀锌铁皮和镀锡铁皮,用小刀在上面刻划,露出里面的铁,然后 在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片?;
在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片?;
在铁片上发生的电极反应式为;
在另一种金属上发生的电极反应式为。