(6分)
25 ℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是__________。
4分)下列各组物质(填序号) ① O2和O3② H2、D2、T2 ③ 12C和14C
④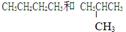
(1)互为同分异构体的是______, (2)互为同位素的是____,
(3)互为同素异形体的是_______, (4)是同一物质的是____。
X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)Z的元素原子结构示意图是:,位于周期表中第_____周期第 族;
(2)有X、Y、Z所形成的离子化合物是 ,它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;
(3)Y的单质的电子式为,结构式为,其中的化学键属于键(填“离子”或“共价”)。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为
v(N2)= mol/(L.min)。
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将_________。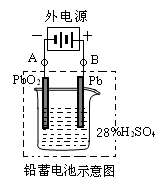
某温度(t ℃)时,水的离子积为KW =1×10-13,则该温度____ 25 ℃(选填“>”“<”“=”),其理由是________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)
(2)若所得混合液的pH=2,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)