(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。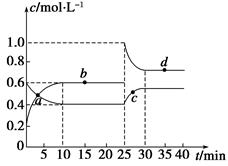
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是_______________________________________________________________________。
(10分)在一密闭容器中发生反应N2+3H2 2NH3.达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
2NH3.达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是(填选项);
(2)t1 t2 t3时刻分别改变的一个条件是(填选项)
A 增大压强B、减小压强 C.升高温度
D、降低温度 E、加催化剂F、充人氮气
t1时刻 t3时刻 t4时刻
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是(填选项);
(4)如果在t6对刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(5)一定条件下,合成氨反应达到平衡时,测得反应混合气中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为
X,Y,Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(g),Y+Z→B(g)。请针对以下两种不同情况回答:
(1)若常温下X,Y,Z均为气体,A的相对分子质量大于B,且A和B化合生成固体C时有白烟产生,则:①C的电子式是__________;②B溶于水的过程中存在的可逆反应式为___________________________。
(2)若常温下Y为固体,X,Z为气体,A在空气中充分燃烧可生成B,则:①A的化学式是_________;②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是_______________________。③若A的燃烧热为M kJ·mol-1,试写出该反应的热化学方程式_____________________
(1)实验室制NH3的反应方程式为_____________________________________
(2)氨的催化氧化是工业制取硝酸的基础,写出化学反应方程式。
(3)硝酸具有强氧化性,它能和许多物质发生反应。写出浓硝酸与非金属单质碳的反应方程式。
(4)写出稀硝酸与金属银在加热条件下的反应方程式 _______________________________________________________
(1)G.H.盖斯,根据一系列事实于1840年提出“不管化学过程是一步或分数步完成,这一过程热效应相同”。换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同。应用这个原理,解决下列问题:
已知:①C(s)+O2(g)==CO2(g)∆H=" -393.5kJ/mol②CO(g)+1/2" O2(g)==CO2(g)∆H= -283kJ/mol
写出C(s)与O2(g)反应生成CO(g)的热化学方程式:___________________________________
(2)反应:2A(气) B(气)+xC(气),在一定的条件下达到平衡状态,密闭容器中的压强增大P%,测得A的转化率为P%,,则x的值为_____.
B(气)+xC(气),在一定的条件下达到平衡状态,密闭容器中的压强增大P%,测得A的转化率为P%,,则x的值为_____.
(1)在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出1.12L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为3.6g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:(1)实验I能确定一定不存在的离子是。
(2)实验I中生成沉淀的离子方程式为。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度_______,若不存在说明理由________ 。
(5)Ⅰ、溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,该反应被氧化的元素为(写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是个。
Ⅱ、请按要求书写化学方程式或离子方程式。
(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,请用化学方程式表示亚硫酸钠变质的原因。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式_。