某研性学习小组用下图装置验证二氧化锰对氯酸钾分解的催化作用,实验时均以生成25mL气体为准,相关数据见下表:
(1)仪器组装完成后,检验该套装置气密性的操作_________________________________________.
(2)上述实验中的待测数据应是________________________________________________.
(3)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中应注意_______________________________________________________.
(4)实验小组经过讨论,认为上述实验还不能完全证明MnO2一定起了催化作用,需再补做实验。请利用实验反应后的剩余物和下面提供的合适用品补做实验(简要说明实验步骤,可不填满,也可以补充)。提供的用品有:H2O2溶液、浓盐酸、硝酸、MnO2、NaOH溶液、AgNO3溶液、KClO3、木条、淀粉-KI试纸、蒸馏水及必要的实验仪器。
①_____________________________________________________________________________
②_____________________________________________________________________________
③_____________________________________________________________________________
【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是(选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是(选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入气体,再从b管中通入气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述):。

(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、。
②检查好装置的气密性后加热B前必须进行的操作是。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是。
实验室可用NaNO3和浓H2SO4反应制取少量的硝酸(1)写出该反应的化学方程式______。
(2)必须用固体NaNO3的原因是______。
(3)实验时加热温度不宜过高的原因是______。
(4)实验装置中,不能用橡胶塞、橡胶导管的原因是______。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色的纯净Fe(OH)2沉淀。应用如图7-5电解装置可制得白色的纯净Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为______,电极反应式为______。
(2)电解液c可以是(填编号)______。
A.纯水
B.NaCl溶液
C.CuCl2溶液
D.NaOH溶液
(3)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)______。
A.改用稀硫酸作用电解质溶液
B.增大电源电压
C.适当减小两电极间的距离
D.适当降低电解质溶液的温度
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下: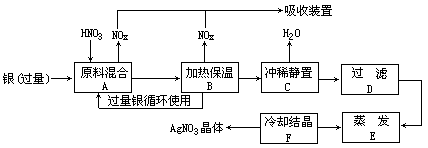
根据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用______硝酸(填浓或稀)原因是______
(a)减少过程中产生NOx的量(b)减少原料银的消耗量(c)节省硝酸的用量
(2)步骤B加热保温的作用是______
(a)有利于加快反应速度 (b)有利于未反应的硝酸挥发 (c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤c是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是______;
(a)置换反应 (b)水解反应 (c)氧化——还原反应产生的沉淀物化学式:______