(6分)(1)在标准状况下,有下列物质:①4 g H2 ②33.6 L CH4 ③1 mol H2O ④3.01×1023个O2 ,其中含分子数最多的是(请在横线上填写序号,下同) ,含原子数最少的是 ,质量最大的是 ,体积最小的是 ;
(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是 ;
(3)若1克H2O中含有a个氢原子,则阿伏加德罗常数用含a的代数式可表示为 。
(17分)合成氨工业上常用下列方法制备H2:
方法:
方法:

试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应: 其相关数据如下表所示:
其相关数据如下表所示:
①T1_________T2(填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K="_________" 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.
B.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表: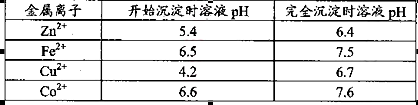
该温度下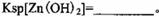 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中 ,则处理1
,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是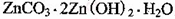 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
(12分)l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:
_________________________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理
由是________(填正确答案的标号,下同)。
| A.乙烯与溴水易发生取代反应 |
| B.使溴水褪色的物质,未必是乙烯 |
| C.使溴水褪色的反应,未必是加成反应 |
| D.浓硫酸氧化乙醇生成的乙醛,也会使溴水褪色 |
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为________,其作用是________B中的试剂为________,其作用是________。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________,该仪器在使用前须清洗干净并_________。
【化学——选修5:有机化学基础】
有机化合物A的分子式为C4H9Br,A分子的核磁共振氢谱有3个吸收峰,其面积之比为2:1:6,利用A按照下列合成路线可以合成调味剂 ,注:部分物质省略。
,注:部分物质省略。
已知:①B在一定条件下可以合成一种高分子化合物,C和D互为同分异构体;
试回答下列问题:
(1)化合物B的系统命名是__________,B生成高分子化合物的化学方程式为__________
____________________________________________________________.
(2)D的结构简式为________________________。
(3)由B经两步反应转化为C经历的反应类型为__________ 和___________。
(4)E转化为F的化学方程式为_________。
(5)F的同分异构体需符合下列条件:①分子中含有苯环,苯环上共有2个取代基,且处于对位;②能与溶液反应生成CO2。符合条件的同分异构体共有_________种,其中一种异构体的核磁共振氢谱只有5个吸收峰,且吸收峰面积之比为3:2: 2:1:6,则该异构体的结构简式为 __________________.
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。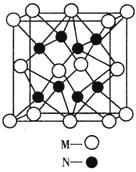
(5)该晶胞的边长为a×10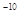 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。