(1)通过NOx传感器可监测NOx的含量,固体体电解质可以传导O2-其工作原理示意图如下: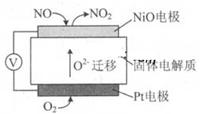
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
(2)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。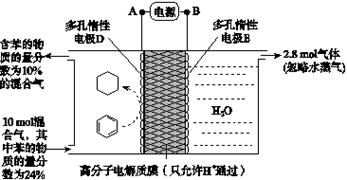
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
卤代烃A(C2H5X)是一种无色液体,为探究A的性质,设计如下实验方案。
方案一:往A中加入硝酸银溶液,充分振荡,静置。
方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液。
方案三:往A中加入过量NaOH乙醇溶液,共热,充分反应后,取溶液少许,依次加入试剂B、硝酸银溶液,得浅黄色沉淀。
根据以上信息回答问题。
(1)C2H5X中的X是。(写化学式)
(2)方案一中可观察到溶 液分层,设计简便方法,判断何为“水层”。
液分层,设计简便方法,判断何为“水层”。
(3)有人认为方案二达不到检验X-的实验目的,理由是。
(4)方案三中,试剂B是。写出方案三中可能发生反应的化学方程式。
(5)将A与过量NaOH乙醇溶液共热生成的气体通入溴的四氯化碳溶液中,溶液褪色,原因是。
某溶液含有下表离子中的几种(不考虑水的电离及离子的水解)。溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种。
| 阳离子 |
Ba2+ NH4+ Fe3+Al3+ Fe2+ |
| 阴离子 |
OH-CO32-Cl-SO32- SO42- |
①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A。
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀。过滤,得滤液B。
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成。过滤,得滤液C,此过程中沉淀的量不减少。
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成。
根据上述实验回 答下列问题。
答下列问题。
(1)写出步骤③中产生红褐色沉淀的离子方程式。
(2)原溶液中一定不存在的阴离子是。
(3)原溶液中的物质在空气中很容易被氧化,设计简单实验予以证明。简述操作步骤及可能观察到的实验现象。
(4)若原溶液由一 种盐溶解于水制得,则该盐的化学式为。
种盐溶解于水制得,则该盐的化学式为。
(5)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的
化学式为、,其物质的量之比为。实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是。
A、B、C、D、E均为中学化学常见的10电子粒子。已知,M(A)>M(B),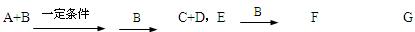
C是一种重要的化工原料。下图表示在1L的密闭容器中,一定条件下X、Y、C三种气体因发生反应而导致的物质的量随时间的变化情况。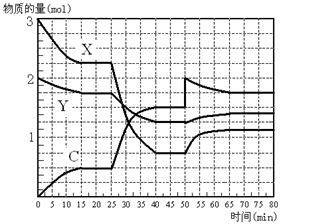
回答下列问题。
(1)写出B的电子式。
(2)写出F G的离子方程式。
G的离子方程式。
(3)根据题图写出相关的化学方程式。(用化学式表示)
(4)下表为一定条件下平衡混合物中C的体积分数(C%)。分析数据可知,表中a的取值范围是。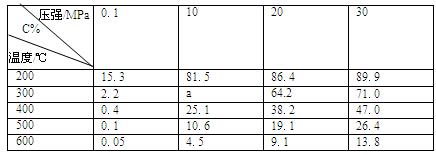
(5)根据题图和题表分析,25 min ~ 40 min内曲线发生变化的原因可能是(填选项代号,下同);50 min ~ 65 min曲线发生变化的原因可能是。
A.降低温度B.增加C的物质的量 C.加了催化剂D.缩小容器体积
(6)工业上合成C的温度一般选择在500℃左右,主要原因是。
用乙醇制取乙二醇(HOCH2—CH2OH),需要经过3个阶段,依次写出反应的化学方程式,并注明反应类型:
(1)反应方程式,反应类型。
(2)反应方程式 ,反应类型。
,反应类型。
(3)反应方程式,反应类型。
(共20分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ___,完全燃烧时消耗O2的量最多的是__ _,
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备:
②乙 烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色
烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠溶液共热
⑧由甲苯制取TNT ⑨往苯酚钠溶液中通入CO2溶液中
(1)其中属于取代反应的是;属于氧化反应的是;
属加成反应的是属于聚合反应的是
(2)写出⑦、⑧、⑨的化学方程式
⑦
⑧
⑨