Ⅰ、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: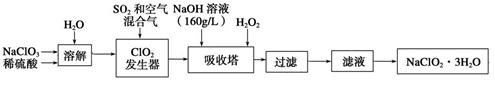
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
② 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1 L。
(1)160 g/L NaOH溶液的物质的量浓度为: (结果保留三位有效数字)
(2)发生器中鼓入空气的作用是: 。
(3)写出吸收装置内发生反应的化学方程式,并标出电子转移方向和数目: ;吸收装置中的温度不能过高,其原因是: 。
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是_____(选填序号)
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
Ⅱ、在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 KOCN + 2KCl + H2O
KOCN + 2KCl + H2O
再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:
____ KOCN + ____ KOH + ____Cl2 ____ CO2 + ____ N2 + ____ KCl + ____H2O
____ CO2 + ____ N2 + ____ KCl + ____H2O
(2)实验室用MnO2与浓HCl制取Cl2, 在答卷上画出虚线框内制取Cl2的装置图,并标出实验药品。
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量。测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出。(化学式量:Na2CO3-106,NaHCO3-84)
(1)分别写出上述转化反应的离子方程式:
________ ____、_____________。
(2)某天然碱的化学式为xNa2CO3·NaHCO3·2H2O,为了测定其组成,取0.3320 g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000 mol·L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL。
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、____________。
②该天然碱化学式中x=_________。
(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表。
限选试剂:0.1000 mol·L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
| 实验步骤 |
结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解,_____________________。 |
有白色沉淀生成,说明产品中含有NaCl。 |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000 mol·L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1。 _____________________,记录消耗盐酸的体积V2。 |
____________, 说明产品中含有NaHCO3。 |
某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 |
黑色粉末逐渐溶解,有无色气体逸出。 |
| ② |
向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 |
溶液未出现血红色 |
(1)由上述实验现象推断,黑色粉末X的成分中是否一定不含Fe3O4?____(填“是”或“否”)。
(2)实验①中可能发生反应的离子方程是,,。
Ⅱ.定量测定
(3)操作Z是。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。
(4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。
某次实验需用0.4 mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面________________________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,________________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.所用的NaOH中混有少量Na2O |
| B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| C.配制溶液所用的容量瓶洗净后没有烘干 |
| D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):(a)→()()→()()→()()→()()→()()→(l)
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为g,化学式为;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。。
实验室欲配制0.5 mol/L的NaOH溶液500 ml有以下仪器:①烧杯;②100 ml量筒;③100 ml容量瓶;④500 ml容量瓶;⑤玻璃棒;⑥托盘天平(带砝码)。
(1)配制时,必须使用的仪器有(填代号),还缺少的仪器是。该试验中两次用到玻璃棒,其作用分别是,。
(2)使用容量瓶前必须进行的一步操作是。
(3)配制溶液时,一般可以分为以下几个步骤:①称量;②计算;③溶解;④摇匀;⑤转移;⑥洗涤;⑦定容;⑧冷却。其正确的操作顺序为。
(4)在配制过程中其他操作都正确的,下列操作会引起误差偏高的是。
①没有洗涤烧杯和玻璃棒②未等NaOH溶液冷却至室温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水④定容时俯视标线⑤定容时仰视标线