【化学——选修2:化学与技术】
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图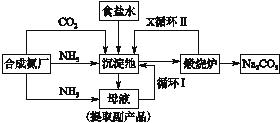
(1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式)。原因是______________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
在一容积为2 L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)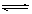 CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示:
CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示: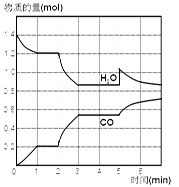
(1)反应处于平衡状态的时间区间是_____________。
(2)若反应进行到2 min时,改变了温度,使曲线发生如右图所示的变化,则温度为______(选填“升高”或“降低”),逆反应是____________(选填“吸”或“放”)热反应。
(3)反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示变化,该条件可能是下述中的_________________。
| A.增加了C | B.增加了水蒸气 | C.降低了温度 | D.增加了压强 |
现有一盛有无色固体物质M的试剂瓶,标签已破损(见图)。已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱。由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性。
(1)若M的水溶液为中性,则实验室检验M中阴离子的离子方程式为_____________________________________。
(2)若M的水溶液呈碱性,加入过量盐酸后产生无色无味的气体,则产生的气体的化学式为_______________。
(3)若M置于空气中易被氧化为另一种物质,生成物的摩尔质量比M增加了16,则M的化学式为_______________。
(4)若M的水溶液呈碱性,加入过量盐酸后产生腐卵臭气味的气体,则M与盐酸反应后生成的气体在过量空气中燃烧的化学方程式为________________________。
现有W、X、Y三种元素,其结构与性质的描述如下表:
| 元素编号 |
元素结构及性质信息 |
| W |
短周期元素,原子最外层有5个电子,液态单质常用于冷冻生命器官 |
| X |
最外层电子数与内层电子数之差为4,高空中该元素的某种单质具有阻挡紫外线的作用 |
| Y |
最外层电子数与X相同,单质燃烧后产生具有漂白性的气体 |
(1)写出X原子的结构示意图___________________;由W元素组成的单质的电子式__________________。
(2)用一个化学方程式表示X、Y的非金属性强弱:________________________。
(3)常温下,由1 g Y元素组成的单质与氢气反应,放出625 J热量,写出该反应的热化学方程式_________________________________________,从能量的角度分析,由0.5 g X元素组成的单质与氢气反应时,放出的热量____________(填“大于”、“小于”或“等于”)625 J。
(4)在新疆与青海交界处有一狭长的山谷,当地牧民经常遇到在风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜皆遭雷击而倒毙,被当地牧民称为“魔鬼谷”。奇怪的是这里牧草茂盛,四季长青。请用化学方程式表示“魔鬼谷”牧草茂盛的原因:
①_______________________________________________;
②_______________________________________________;
③_______________________________________________。
分已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
分人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+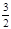 O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。
Ⅱ.目前工业合成氨的原理是:N2(g)+ 3H2(g) 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题: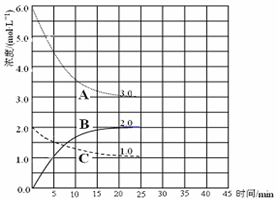
① 表示N2的浓度变化的曲线是(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、 “减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。