(2014)某化学兴趣小组的同学在实验室配制质量分数为20%的碳酸钠溶液,并完成有关实验。
(1)配制100g质量分数为20%的碳酸钠溶液。
①配制方法A、需要碳酸钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
配制方法B、若用40%的碳酸钠溶液稀释成100克20%碳酸钠溶液,则需取40%的碳酸钠溶液多少亳升?(密度为1.4克/毫升) (填答案)。
②配制溶质质量分数一定的碳酸钠溶液常按以下操作顺序进行。
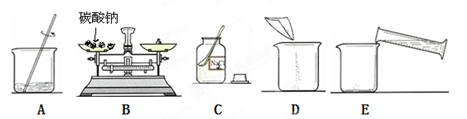
则用上图所示的序号表示正确配制该溶液的操作顺序为 。
③用托盘天平称量所需的碳酸钠时,发现托盘天平的指针偏向左盘,应 。
A.增加适量固体 B.减少适量固体
C.调节游码 D.添加砝码
④分析:以下原因可能导致配到的碳酸钠溶液溶质质量分数小于8%的是( )
A、固体中混有杂质
B、量水时仰视读数
C、配好后装入试剂瓶中时有少量液体洒出
D、量水时俯视读数
(2)取上述配制得到的20%的碳酸钠溶液53克,加入68.4克某浓度的稀盐酸后,恰好完全反应,求反应后所得溶液的溶质质量分数。
学校在进行消防演练过程中,老师带领学生使用干粉灭火器进行模拟灭火演练。化学兴趣小组收集灭火后残留的白色固体,探究其成分。(不考虑杂质的影响)
【查阅资料】①干粉灭火器的主要成分是NaHCO3;②2NaHCO3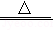 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
③碳酸氢钠与氯化钙不发生反应。
请写出干粉灭火器的灭火原理: 。
【提出猜想】猜想一:固体成分为Na2CO3; 猜想二:固体成分为NaHCO3;
猜想三:固体成分为 。
【实验验证】
|
步骤 |
现象 |
结论 |
|
小明同学取少量白色固体于试管中,加水溶解,再滴入无色酚酞溶液 |
无色酚酞溶液变红 |
猜想一成立 |
【提出质疑】小红认为小明得出的结论不准确。小红知道NaHCO3在医疗上是治疗胃酸过多症的一种药剂,推测NaHCO3的水溶液可能显 性,并通过实验得到了验证。
小明和小红继续实验探究:
|
步骤 |
现象 |
结论 |
|
1.取少量白色固体加热,将生成的气体通入澄清石灰水中。 |
澄清石灰水变浑浊 |
固体中含有NaHCO3,写出石灰水变浑浊的化学方程式: 。 |
|
2.另取少量的有色固体加水溶解,向所得溶液中滴入氯化钙溶液。 |
|
固体中含有Na2CO3,写出发生反应的化学方程式: 。 |
【得出结论】猜想三成立。
【反思交流】师生通过交流又设计了另一种实验方案。
|
实验装置 |
步骤 |
现象 |
结论 |
|
|
m的数值为 g;将注射器内等质量分数的足量稀盐酸同时加入试管中,关闭弹簧夹,观察现象。 |
甲、乙、丙的三支试管中均有气泡产生,U型管右侧液面均升高,待反应结束后液面由高到低的顺序为 。 |
猜想三成立 |
【拓展延伸】掌握和运用定性和定量分析的方法有利于我们认识化学反应过程,更有助于解决生活、生产实践中的问题。
兴趣小组设计如下实验证明某混合气体中可能含有CO、CO 2、H 2(实验过程中装置气密性良好)。温馨提示:白色硫酸铜粉末遇水变蓝色。
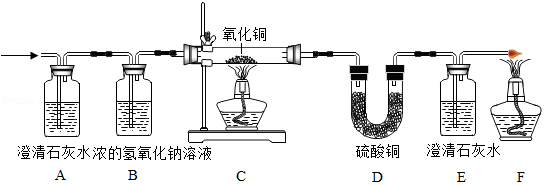
(1)A中澄清石灰水变浑浊,说明气体中含有 ;
(2)B的作用是 ,写出B中反应的化学方程式: ;
(3)实验时小明发现C中黑色固体变红,D中白色粉末变蓝,于是得出混合气体中含有H 2,小红认为小明的结论不严密,理由是 。
(4)如图所示的装置被称作"万能瓶",它在化学实验中有广泛的应用。除用于洗气、验证气体的功能外,还有 功能。(答出一点)

如图是实验室常用的实验装置。请回答下列问题:

(1)仪器①的名称为 ;
(2)实验室选用A作高锰酸钾制取氧气的发生装置,还需要补充的一种用品是 ,该反应的化学方程式为 ,用D收集氧气做铁丝燃烧的实验,集气瓶中留有少量水的目的是 ;
(3)实验室制取CO2的发生和收集装置是 (填字母),发生反应的化学方程式为 ,检验集气瓶中是否已收集满CO2的方法是 ;
(4)选用B和D制取气体时为了随时控制反应发生和停止,小明同学认为只要在B和D的连接处直接安装弹簧夹即可。你认为这种做法是否可行并说明理由: 。
以下是实验室常用到的仪器。请结合图示回答问题:

(1)取用固体药品时用到的仪器是 (填字母);
(2)胶头滴管的用途是 ;
(3)过滤操作时使用到的玻璃仪器有 (填字母)。
为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如下实验

(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式 。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为20%的氢氧化钾溶液的质量为 。
(4)样品中硫酸铜的质量分数为 。
(5)D烧杯溶液中溶质的质量分数为 。
(6)若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为 。