2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 2CO2 (g) +N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
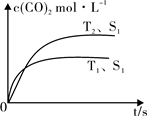
①该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ•mol-1。
CH3OH(g)△H =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强比(P后/P前) |
0.98 |
0.90 |
0.80 |
0.70 |
0.70 |
0.70 |
达到平衡时CO的转化率为 。
(4)氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1氨水所得的滴定曲线如下:
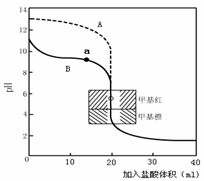
请指出盐酸滴定氨水的曲线为 (填A、B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 。
(5)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验验中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(6)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为4NH3+3O2=2N2+6H2O。写出该燃料电池的正极反应式 。
二甲醚具有优良的燃烧性能,被称为21世纪的“清洁能源”,以下为其中一种合成二甲醚的方法:在一定温度、压强和催化剂作用下,在同一反应器中进行如下反应:
①CO2(g)+3H2(g) CH3OH(g) +H2O(g)△H1=-49.1 kJ·mol-1
CH3OH(g) +H2O(g)△H1=-49.1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24.5 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
(1)写出CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式是。
(2)一定条件下,原料气中n(H2)/n(CO2)比值和温度对CO2转化率影响的实验数据如下图。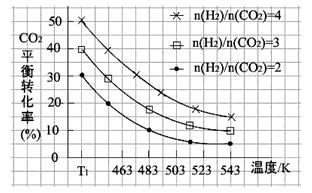
①温度为T1 K时,在1 L反应容器中投入2mol CO2 和8mol H2进行反应,试计算达到平衡时CO2的浓度为。
②结合数据图,归纳CO2平衡转化率受外界条件影响的变化规律:
a。
b。
(3)为研究初始投料比与二甲醚产率关系,在一定温度和压强下,投入一定物质的量的H2、CO、CO2进行试验,实验发现二甲醚的平衡产率随原料气中n(CO)/〔n(CO)+n(CO2)〕比值增大而增大,试分析其原因。
(4)下图是科学家现正研发的,以实现反应①在常温常压下进行的装置。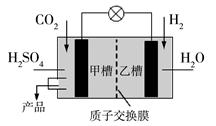
写出甲槽的电极反应。
由有机物Ⅰ合成Ⅳ(香豆素)的合成路线如下:
回答下列问题:
(1)写出分子式:丙烯酸甲酯____________________;
(2)写出反应类型:Ⅰ→Ⅱ ;若要Ⅱ→Ⅲ的反应完全,则Ⅱ→Ⅲ 反应需要的条件是;
(3)已知化合物Ⅳ的相对分子质量为146,写出结构简式:Ⅳ;
(4)化合物V是Ⅲ的一种同分异构体,V有如下特征:分子中除苯环外,无其它环状结构;在核磁共振氢谱图中,有四个吸收峰;能发生银镜反应;1 mol V最多能与2mol的NaOH反应。V的结构简式为________________;
(5)根据已有知识并模仿香豆素合成路线的相关反应,试写出以氯苯和丙烯(CH2=CH-CH3)为原料,合成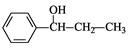 的化学方程式(无机试剂任选)。
的化学方程式(无机试剂任选)。
(12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A.【物质结构与性质】
利用工业废铁粉(主要成为Fe3O4、Fe)与硫酸反应可制备硫酸盐。
(1)Fe2+基态核外电子排布式为________。
(2)FeSO4隔绝空气受热分解生成SO2、SO3、Fe2O3。SO2分子的空间构型为__________,其中S原子的杂化类型为________。与SO3互为等电子体的离子与分子分别为________、________(填化学式)。
(3)苯酚可以与Fe3+发生显色反应。1 mol苯酚中含有σ键的数目为________。
(4)Fe3O4具有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A、B方块组成。该化合物的化学式为________。
(14分)大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为CH4(g)+4NO(g)===CO2(g)+2N2(g)+2H2O(l),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是________。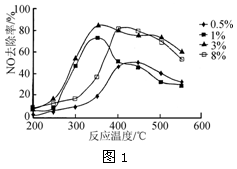

(3)臭氧也可用于烟气脱硝。
①O3氧化NO结合水洗可产生HNO3和O2,该反应的化学方程式为____。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为________。
(4)图3是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为________。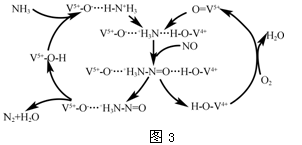
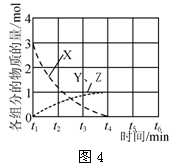
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式:____。
(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。