还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: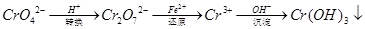
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq) 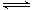 Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
若NA表示阿伏加德罗常数的值,下列叙述正确的是()
| A.常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| B.标准状况下,11.2LNH3所含共价键的数为3NA |
| C.标况下11.2LNO和11.2LO2混合后所得气体分子数为NA |
| D.2Llmol/L的醋酸溶液中所含氢离子数为2NA |
为达到预期的实验目的,下列操作正确的是()
A.欲配制量分数为10%的ZnSO4溶液,将10gZnSO4 7H2O溶解在90g水中 7H2O溶解在90g水中 |
| B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeC13饱和溶液并长时间煮沸 |
| C.可以使用乙醇提取溴水中的溴单质 |
| D.为鉴别KC1、A1C13和MgC12溶液,各取少量三种溶液分别滴加NaOH溶液至过量 |
根据砷元素的原子结构示意图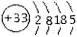 ,做出如下推理,其中与事实不符的是()
,做出如下推理,其中与事实不符的是()
| A.砷元素位于元素周期的第四周期、第VA族 |
| B.砷原子不如溴原子的得电子能力强 |
| C.砷酸酸性比磷酸酸性强 |
| D.在相同条件砷元素的氢化物的稳定性弱于氨气 |
下列有关实验的做法错误的是()
| A.分液时,分液漏斗中的上层液体应由上口倒出 |
| B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体 |
| C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl- |
| D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3 |
下列实验或实验操作达到实验目的的是() 
| A.图I:将海带灼烧成灰 |
| B.图II:检验装置的气密性 |
| C.图III:制取少量纯净的CO2气体 |
| D.图IV:蒸干NH4Cl饱和溶液制备NH4Cl晶体 |