从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),试回答:
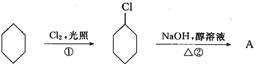
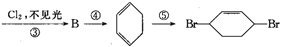
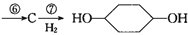
(1)化合物的结构简式:B ,C 。
(2)②的反应类型是 ;③的反应类型是 ;
(3)反应⑥所用试剂和条件是 。
已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___570 kJ(填“>”、“<”或“=”)。
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4完全燃烧生成CO2气体和H2O(l)的热化学方程式为。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。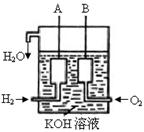
该电池的正极为:______(填A或B)。电极反应式为 ________ ____ 。
(4)若将上述装置中通入H2的改成CH4气体,也可以组成一个原电池装置,电池的总反应为:CH4+2O2+2KOH = K2CO3+3H2O ,则该电池的负极反应式为:______ __ 。
硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 | C.充入大量的氮气 | D.仅增加SO2的浓度 |
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____ _
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有____种,金属性最强的元素与氧气反应生成的化合物有______________(至少填两种化合物的化学式);
(2)属于稀有气体的是_________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是__________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)____________;
(5)推测Si、N最简单氢化物的稳定性由强到弱排列_____________(填化学式)。
决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/K |
1266 |
1534 |
183 |
解释MgF2与SiF4熔点差异的原因。
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
则A的电负性B的电负性(填“>”、“<”或“=”)。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。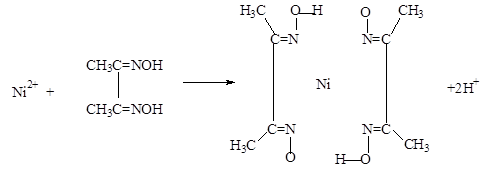
等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为;分子中σ键和π键数之比为。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n=。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| C-O |
C=O |
C≡O |
|
| CO |
357.7 |
798.9 |
1071.9 |
| N-N |
N=N |
N≡N |
|
| N2 |
154.8 |
418.4 |
941.7 |
CO与N2中化学性质较活泼的是;结合数据说明原因。
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN-形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3-互为等电子体的分子(写出一种)。