滴定实验是化学学科中重要的定量实验。
请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写) →c→ → →d→ →
②在G操作中如何确定终点? 。
③在G操作中,眼睛应观察 (填选项字母)
A.锥形瓶中溶液颜色变化 B.滴定管中溶液液面的变化
(2)下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 |
待测液体积(mL) |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
(1)滴定时,KMnO4溶液应装在 (“酸”或“碱”)式滴定管中,滴定终点时滴定现象是 。
(2)该草酸溶液的物质的量浓度为_____________。
(15分)某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I: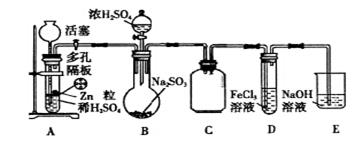
(1)实验基本操作分析:
①多孔隔板与活塞相配合,能起到的作用是_____________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMn O4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).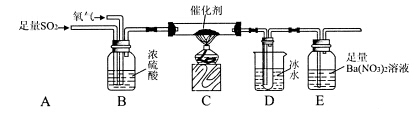
①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是:____________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
(15分)某工业废料钡泥中主要含有BaCO3、BaSO3、Ba(FeO2)2等,某实验小组模拟工业过程利用钡泥制取BaCO3和Ba(NO3)2晶体(不含结晶水),其实验流程如下: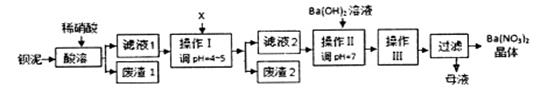
已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分虽为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃; Ba(NO3)2的溶解度在高温时较大,低温时较小;
③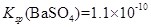 ,
,  .
.
(1)酸溶时,BaCO3发生反应的离子反应方程式为___________________________________
(2)酸溶后,滤液1除了Ba2+外,还存在的阳离子是____________________等(填写离子符号)。
(3)加入X的目的是_______________________________________________。
(4)若在操作II中加入Na2CO3来制取BaCO3,经检验所得BaCO3中含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌和静置后,弃去上层清液。如此反复多次处理,直到BaSO4全部转化为BaCO3,该提纯原理的离子反应方程式是_______________________________________
(5)若用(4)的方法处理含有0.21mol BaSO4样品,每次用1.0 L 2.0mol·L-1饱和Na2CO3溶液,则至少需要处理________次,BaSO4才能全部转化BaCO3。
(6)操作III的名称是:________、冷却结晶、_________、洗涤、干燥。
(7)上述流程中对环境的影响主要有_________。因此要进一步处理,避免造成二次污染。
某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验Ⅰ按下图所示进行实验。
(1)实验前需除去镁条表面氧化膜。用简易的物理方法除氧化膜的操作是;
(2)实验室制取二氧化硫的化学方程式为;
(3)上述装置存在不合理之处,请提出1项改进建议;
(4)实验时,先通入SO2直到现象出现后,再点燃酒精灯;此操作目的是。
实验Ⅱ确定固体M的成分。
实验装置如图所示。
将分液漏斗中稀硫酸(足量)
加入到烧瓶中,完全反应后,实验现象如下:
| 装置 |
A |
B |
C |
量气管 |
| 现象 |
有残留 固体 |
产生白色ZnS沉淀 |
溴水 未褪色 |
进入气体 v mL(标况) |
(5)实验时,B装置中反应的化学方程式为;
(6)已知镁的相对原子质量为24,则固体M中金属镁的质量为g;实验前装置内有空气,对金属镁质量的测定结果的影响是(填偏低、偏高、无影响);
(7)依以上实验,可确定固体M的成分有种(填数字)。
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步骤 |
现象 |
| Ⅰ.将NaCl与AgNO3溶液混合 |
产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 |
沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 |
较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是。
(2)Ⅱ中能说明沉淀变黑的的离子方程式是,沉淀转化的主要原因是。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 |
B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |

①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S +  +
+ + 2H2O
+ 2H2O  4AgCl +
4AgCl + + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
(1)Cu2S中Cu元素的化合价是价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。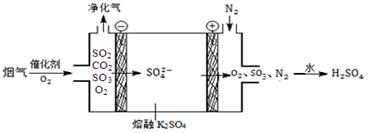
①在阴极放电的物质是。
②在阳极生成SO3的电极反应式是。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用。
②若沉淀的质量越大,说明SO2的脱除率越(填“高”或“低”)。