某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
(1)A装置中发生反应的化学方程式为: 。
(2)装置B的作用是 。
(3)请给标记为F的实线方框选择合适的装置 。
(4)AlCl3遇潮湿空气即产生大量白雾的原因是 (结合化学方程式说明)。
(5)有同学认为装置E中有不足之处,存在安全隐患。若你同意他的观点,请指出其不足之处 。
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。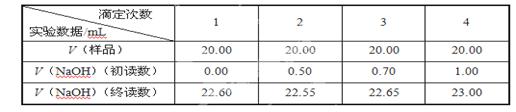
①经计算,该次滴定测的试样中盐酸浓度为 mol·L-1。
②在本实验的滴定过程中,下列操作会使实验结果偏小的是 (填写序号)。
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
现行中学教材中,有以下化学实验:
A.溴乙烷的水解
B.浓硫酸跟乙醇反应制乙烯
C.乙醛还原新制的氢氧化铜
D.乙酸乙酯的制取
E.石油的蒸馏
F.葡萄糖的银镜反应
G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C、——完成以下填空:(多填扣分)
(1)需用水浴加热的是;
(2)实验装置不需要检查气密性的是;
(3)为防止液体暴沸,常需加少量碎瓷片的是;
(4)需用温度计的是。
(11分)如图是某同学设计的放热反应的观察装置,其实验操作是: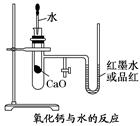
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液)打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹;
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,即可观察.
试回答:
(1)实验中观察到的现象是。
(2)该实验中必须进行的一步实验操作是。
(3)该实验的原理是。
(4)实验中发生的化学反应方程式:。
(5)说明CaO、H2O的能量与Ca(OH)2能量之间的关系:。
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?(填“能”或“否”).
(本题7个空,每空2分,共14分)
喷泉是一种常见的现象,其产生的原因是存在压强差。
(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,请用简单的语言来描述此过程:
。
(2)用图Ⅰ装置进行喷泉实验,请写出引发喷泉的操作。若图Ⅰ的圆底烧瓶中充满标况下的HCl气体,反应后溶液充满整个烧瓶,则烧瓶内溶液的物质的量浓度为。
(3)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是。
| A.Cu与稀硝酸 | B.Cu与稀硫酸 |
| C.CaCO3与浓硝酸 | D.Fe与浓硝酸 |
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。
①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为
。
②在①操作的基础上,打开活塞c,产生的现象是
。
(5)实验室中某同学想制备部分氨气,设计了下面的装置,并选用相关试剂,其中错误的是。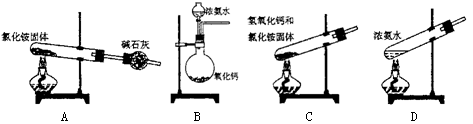
(本题共14分)
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷。以废旧铁屑(含少量CuO、Fe2O3等杂质)为原料的制备流程如下:
(1)操作3发生的氧化还原反应至少有个.操作5中试剂H2O2的作用是·
(2)滤液中主要含FeSO4,需加入少量的H2SO4酸化,目的是.若要使含FeSO4溶液中得到绿矾晶体(FeSO4·7H2O)。必须进行的实验操作是(按顺序填写)。
A.过滤洗涤
B.蒸发浓缩
C.冷却结晶
D.灼烧
E.干燥
(3)三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验
装置检查气密性后,先通一段时间N2,其目的为。结束实验时先熄灭酒精灯再通入N2至常温,其目的为.实验过程中观察到B、F中澄清石灰水都变浑浊。E中有红色固体生成,则气体产物是.
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。学生甲、乙、丙分别设计了下列三种实验方案对该样品进行物质含量测定。
【甲】
【乙】
【丙】
你认为以上方案中,方案无法确定样品的组成,理由是.
(12分)某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
反应原理:
实验步骤:
①配制浓硫酸与浓硝酸(体积比按1:3)的混合物(即混酸)40 mL;
②在三颈瓶中加入15 mL甲苯;
③按图所示装好药品,并装好其他仪器;
④向三颈瓶里加入混酸,并不断搅拌(磁力搅拌器已略去);
⑤控制温度约为50℃,反应大约l0min,三颈瓶有大量淡黄色油状液体出现;
⑥分离出一硝基甲苯。
可能用到的有关数据如下:
| 密度/g·cm-3 |
沸点/℃ |
溶解性 |
|
| 甲苯 |
0.866 |
110.6 |
不溶于水,易溶于硝基甲苯 |
| 产品1 |
1.286 |
237.7 |
不溶于水,易溶于液态烃 |
| 产品2 |
1.162 |
222 |
不溶于水,易溶于液态烃 |
请回答下列问题:
(1)配制40mL混酸的操作是。
(2)冷却水应该从冷凝管(填“a”或“b”)处流入。
(3)如果加热一段时间后发现装置漏气,应该采取的正确操作是。
(4)分离产品的方案如下:
操作1的名称是;操作2必需的玻璃仪器共有种。
(5)若最终得到产品1和产品2的总质量为17.42 g,则一硝基甲苯的总产率是(保留到小数点后两位)。