(本题7个空,每空2分,共14分)
喷泉是一种常见的现象,其产生的原因是存在压强差。
(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,请用简单的语言来描述此过程:
。
(2)用图Ⅰ装置进行喷泉实验,请写出引发喷泉的操作 。若图Ⅰ的圆底烧瓶中充满标况下的HCl气体,反应后溶液充满整个烧瓶,则烧瓶内溶液的物质的量浓度为 。
(3)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是 。
| A.Cu与稀硝酸 | B.Cu与稀硫酸 |
| C.CaCO3与浓硝酸 | D.Fe与浓硝酸 |
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。
①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为
。
②在①操作的基础上,打开活塞c,产生的现象是
。
(5)实验室中某同学想制备部分氨气,设计了下面的装置,并选用相关试剂,其中错误的是 。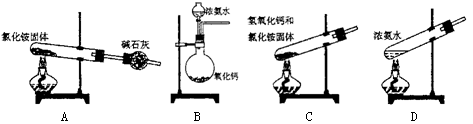
某小组同学为比较酸性条件下ClO-、S、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去)。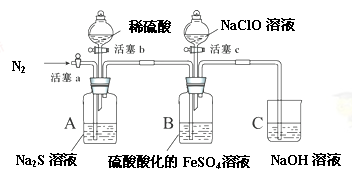
实验步骤及现象记录如下(每步操作进行前均通一段时间N2,排出装置内原有气体。):
1、打开活塞c,向装置B滴加次氯酸钠溶液,溶液立即变为黄色,一段时间后观察到装置B中液面上方出现黄绿色气体时,立即关闭活塞c。
2、用注射器取出少量装置B中的溶液,滴加几滴KSCN溶液,溶液变为血红色。
3、打开活塞b,向装置A中加入足量稀硫酸后,关闭活塞b,观察到装置B中溶液变浑浊。
4、一段时间后,用注射器取出少量装置B中的上层清液,……
请回答下列问题:
(1)在添加药品前需进行的操作是 。
(2) 步骤1中,发生反应的离子方程式是 , 。
(3)步骤3中导致浑浊的物质是 。
(4) 步骤4是为了验证该溶液中存在的金属阳离子只有Fe2+。甲同学认为后续操作应是滴加酸性KMnO4溶液,但乙同学认为该方法不妥,原因是 ;合理的操作及实验现象应该是 。
(5)分析实验现象,可得出该实验的结论是 。
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图: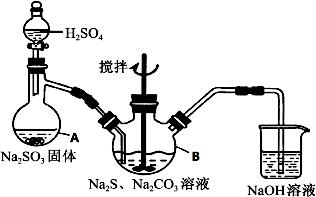
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液VmL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是① 常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数
为 (写化简后的表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
(6)最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3 SO2 NH3 H2O B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O D.Fe2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定______________不成立(填序号)
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)【实验结论与反思】通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用_ ___(填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为 ,充分反应后,加入足量BaCI2溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为 。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是 ,其作用是 。
(4)为判断CO2是否存在,需将装置M添加在 。(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为 。
(5)若C中固体变红,D中固体变蓝,则Q是 (填化学式),产生该气体的原因是 。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为 (填序号)。
a.SO2 b.H2、SO2 c.H2、CO2 d.CO2、SO2 e.SO2、CO2、H2