某小组同学为比较酸性条件下ClO-、S、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去)。
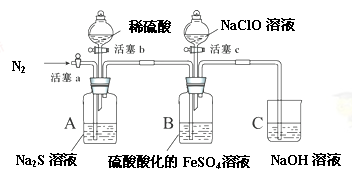
实验步骤及现象记录如下(每步操作进行前均通一段时间N2,排出装置内原有气体。):
1、打开活塞c,向装置B滴加次氯酸钠溶液,溶液立即变为黄色,一段时间后观察到装置B中液面上方出现黄绿色气体时,立即关闭活塞c。
2、用注射器取出少量装置B中的溶液,滴加几滴KSCN溶液,溶液变为血红色。
3、打开活塞b,向装置A中加入足量稀硫酸后,关闭活塞b,观察到装置B中溶液变浑浊。
4、一段时间后,用注射器取出少量装置B中的上层清液,……
请回答下列问题:
(1)在添加药品前需进行的操作是 。
(2) 步骤1中,发生反应的离子方程式是 , 。
(3)步骤3中导致浑浊的物质是 。
(4) 步骤4是为了验证该溶液中存在的金属阳离子只有Fe2+。甲同学认为后续操作应是滴加酸性KMnO4溶液,但乙同学认为该方法不妥,原因是 ;合理的操作及实验现象应该是 。
(5)分析实验现象,可得出该实验的结论是 。
某同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)知识储备:将氯气通入水中的化学方程式为 ;
(2)探究“溶液的红色突然消失”的原因:
①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是 。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为 ,则证明“猜想a”正确;若现象为 ,则证明“猜想b”正确。
某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
Ⅰ.已知:I2+2S2O=S4O+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为 。
②该试样中CuCl2·2H2O的质量百分数为 。
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)△H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中 =1:1)
=1:1)
(4)图中压强( 、
、 、
、 、
、 )由大到小顺序为 。
)由大到小顺序为 。
(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp= (要求写出解题过程)。
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
天然海水中含有非常丰富的化学元素,具有很大的利用价值。工业上对海水资源综合利用的部分工艺流程如下图所示。
(1)请列举海水淡化的两种方法: 、 。
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式 。
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图。步骤①反应的离子方程式是 ;步骤③通入二氧化硫的目的是 ,其反应的化学方程式是 。
(4)步骤⑤蒸馏的过程中,温度应控制在80-90℃。温度过高或过低都不利于生产,请解释其原因: 。
下图为实验室制备乙酸乙酯的装置。


 已知下列数据:
已知下列数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 乙醇 |
-114 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
| 浓H2SO4 |
338 |
1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。