某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。


①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
|
 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物。某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验。
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是______________,
现象很壮观,取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种结果的原因,除了可能混有没反应的磁性氧化铁外,还有一个原因是 。
(2)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是_________,反应的离子方程式为_________________________________。
(3)请写出此铝热反应的化学方程式: 。
每摩铝参与反应,转移的电子数为 。
(4)生成除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以________。
| A.CuO | B.Na2O2 | C.MnO2 | D.MgO |
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精;加入酒精的作用为_______________________________。
(2)向所得混合物中加入_______,静置一段时间,溶液分为上下两层,肥皂在___层。
(3)图中长玻璃管的作用是________________________________________________。
(4)写出该反应的化学方程式______________________________________________。
某化学课外活动小组研究乙醇氧化的实验并验证其产物,并从“乙醇催化氧化实验”得到一些认识有关催化剂的催化机理等问题。
(1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。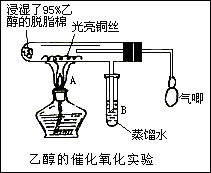
请回答以下问题:
①被加热的铜丝处发生的反应的化学方程式为________。
②从A管中可观察到 实验现象。
(2)乙同学研究乙醇氧化的实验并验证其产物,组合一套实验装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
①若要保证此实验有较高的效率,还需补充的仪器有___________。理由____________。
②实验中能验证乙醇氧化产物的实验现象是__________________________。
③装置中,若撤去高锰酸钾加热部分并用夹子夹K,其它操作不变,则无水硫酸铜无明显变化,其余现象与②相同,推断燃烧管中主要反应的化学方程式___________________。
某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式______________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式__________________________________。
(3)C中盛放CCl4的作用是__________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。
把1 mol CH4和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:
(1)片刻后试管中的现象为:①试管内气体的颜色变浅,②试管壁上出现 、③试管内 。
(2)在反应结束后,试管内的产物最多的是 ,空间构型呈正四面体的产物为 。
(3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为 。