某学生欲通过实验方法验证Fe2+的性质。
(1)该同学在实验前,依据Fe2+的 性,填写了下表。
| 实验操作 |
预期现象 |
反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 |
试管中产生红棕色气体,溶液颜色逐渐变黄 |
Fe2++NO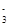 +2H+ =Fe3++NO2↑+H2O +2H+ =Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验。
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红。该现象的结论是 。
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。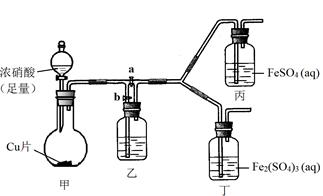
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同。
①铜与足量浓硝酸反应的化学方程式是 ;
②装置乙的作用是 ;
③步骤ⅱ的目的是 ;
④该实验可得出的结论是 。
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 。
Ⅰ.已知:I2+2S2O=S4O+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为 。
②该试样中CuCl2·2H2O的质量百分数为 。
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)△H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中 =1:1)
=1:1)
(4)图中压强( 、
、 、
、 、
、 )由大到小顺序为 。
)由大到小顺序为 。
(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp= (要求写出解题过程)。
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
天然海水中含有非常丰富的化学元素,具有很大的利用价值。工业上对海水资源综合利用的部分工艺流程如下图所示。
(1)请列举海水淡化的两种方法: 、 。
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式 。
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图。步骤①反应的离子方程式是 ;步骤③通入二氧化硫的目的是 ,其反应的化学方程式是 。
(4)步骤⑤蒸馏的过程中,温度应控制在80-90℃。温度过高或过低都不利于生产,请解释其原因: 。
下图为实验室制备乙酸乙酯的装置。


 已知下列数据:
已知下列数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 乙醇 |
-114 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
| 浓H2SO4 |
338 |
1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。
某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液。
查阅资料得知:淀粉遇I2变蓝。
请帮助他们完成以下实验报告:
| 序号 |
实验 目的 |
实验内容 |
实验现象 |
实验结论 |
离子方程式 |
| 实验1 |
① |
在FeCl2溶液中滴入适量 氯水 |
溶液由浅绿色 变为黄色 |
② |
③ |
| 实验2 |
④ |
在FeCl2溶液中加入锌片 |
 |
⑤ |
Zn +Fe2+= Zn2++Fe |
| 实验3 |
⑥ |
在FeCl3溶液中加入足量 铁粉 |
⑦ |
FeCl3(Fe3+)具有氧化性 |
⑧ |
| 实验4 |
⑨ |
在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 |
淀粉溶液变蓝 |
⑩ |
2Fe3++2I-=2Fe2++I2 |
填空:
① ③ ⑤
⑧ ⑩
综合以上实验,你能得到的结论是: 。
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可) 。
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。保存亚铁盐溶液时如何防止亚铁盐被氧化 。
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可): 。
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是 。