某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液。
查阅资料得知:淀粉遇I2变蓝。
请帮助他们完成以下实验报告:
| 序号 |
实验 目的 |
实验内容 |
实验现象 |
实验结论 |
离子方程式 |
| 实验1 |
① |
在FeCl2溶液中滴入适量 氯水 |
溶液由浅绿色 变为黄色 |
② |
③ |
| 实验2 |
④ |
在FeCl2溶液中加入锌片 |
 |
⑤ |
Zn +Fe2+= Zn2++Fe |
| 实验3 |
⑥ |
在FeCl3溶液中加入足量 铁粉 |
⑦ |
FeCl3(Fe3+)具有氧化性 |
⑧ |
| 实验4 |
⑨ |
在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 |
淀粉溶液变蓝 |
⑩ |
2Fe3++2I-=2Fe2++I2 |
填空:
① ③ ⑤
⑧ ⑩
综合以上实验,你能得到的结论是: 。
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可) 。
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。保存亚铁盐溶液时如何防止亚铁盐被氧化 。
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可): 。
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是 。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2: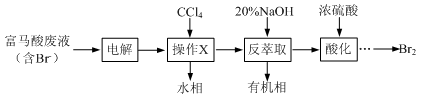
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下: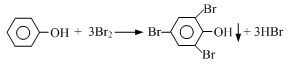
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
【改编】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下:
(1)黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中x、y、z的代数关系式为 。
(2)检验滤液中是否存在NH4+的操作是 。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾中n(OH-): n(NH4+)(写出计算过程) 。
【改编】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
请回答下列问题:
(1)发生器中反应的化学方程式为 ;为了增加生产的安全性在发生器中还需要进行的操作为 。
(2)吸收塔产生的气体X为 (化学式)。
(3)吸收塔的温度不能超过20℃,原因是 。
(4)滤渣的成分为 (化学式)。
(5)从滤液中得到NaClO2•3H2O晶体需要洗涤,为了减少溶解损失可以用 洗涤NaClO2•3H2O晶体。
[实验化学]工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】
【物质性质】
| 试剂 |
沸点(℃) |
溶解度 |
化学性质 |
| 水杨酸 |
211 |
微溶于冷水,易溶于热水 |
|
| 乙酸酐 |
139 |
在水中逐渐分解 |
|
| 乙酰水杨酸 |
|
微溶于水 |
与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。