硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
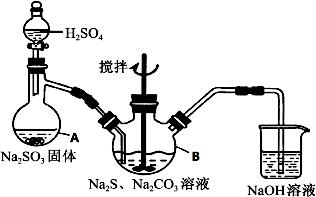
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液VmL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。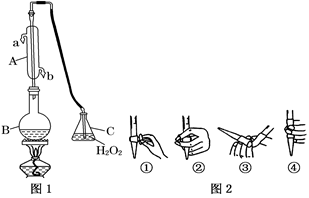
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
| A.c(Na+)=c(HSO3-)+2c(SO32-) |
| B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
| C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
| D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S ="=" Na2S2O3 。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。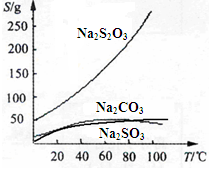
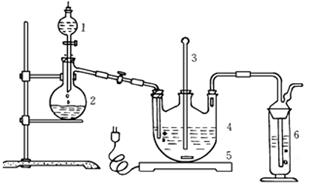
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为,装置6中可放入。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为: ① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O④ Na2SO3+S Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶pH要控制不小于7的理由是:(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
(3)为减少产品的损失,操作①为,操作②是过滤洗涤干燥,其中洗涤操作是用(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:。
③产品中Na2S2O3·5H2O的质量分数为 。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。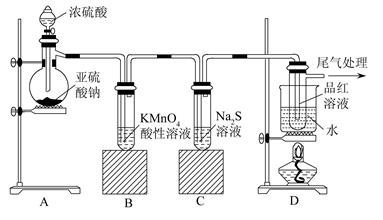
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式___________;
(2)实验过程中,装置B、C中发生的现象分别是_______________、________________,这些现象分别说明SO2具有的性质是_____________和____________;装置B中发生反应的离子方程式为(MnO4-还原为Mn2+)_____________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________;
(4)尾气可采用________溶液吸收。
某同学查阅资料后设计了一条1-丁醇的合成路线:CH3CH===CH2+CO+H2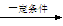 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH。其中CO的制备方法:HCOOH
CH3CH2CH2CH2OH。其中CO的制备方法:HCOOH CO↑+H2O。
CO↑+H2O。
请填写下列空白:
(1)利用以上装置制备CO、丙烯等原料气体,装置中a的作用__________;b的作用_________。
(2)制丙烯时,伴随的副反应还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(3)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
| A.高温、常压、催化剂 |
| B.适当的温度、常压、催化剂 |
| C.低温、高压、催化剂 |
| D.适当的温度、高压、催化剂 |
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为________,操作2为________,操作3为________。
某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇(含18O)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH ; ②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:。
(2)球形干燥管C的作用是。反应结束后D中的现象是。
(3)上述实验中饱和碳酸钠溶液的作用是。
(4)欲从D中得到乙酸乙酯的分离方法是;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;
(5)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有:(请写出两点)
,。 