我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。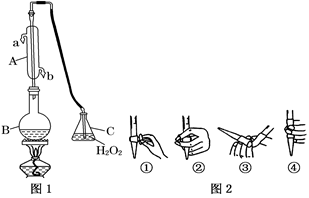
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
| A.c(Na+)=c(HSO3-)+2c(SO32-) |
| B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
| C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
| D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量) (1)判断BaCl2已过量的方法是。
(1)判断BaCl2已过量的方法是。
(2)第④步中,写出相应的化学方程式:
; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在()中的操作名称是____。
中填写所使用除杂试剂的化学式__________,在()中的操作名称是____。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:。
实验室用Na2SO4·10H2O配制0.1mol/L的Na2SO4溶液500ml。有以下仪器:
①药匙②100ml量筒③1000ml容量瓶④锥形瓶⑤玻璃棒⑥烧杯
(1)配制时,必须选用的仪器为:(填代号),还缺少的玻璃仪器为
(2)经计算,本实验需称量硫酸钠晶体(Na2SO4·10H2O)为g。
(3)用Na2SO4·10H2O配制标准溶液的正确顺序是。
| A.冷却 | B.称量 | C.洗涤 | D.定容 E.溶解 F.摇匀 G.移液 |
(4)将所配制的Na2SO4溶液进行测定,发现浓度大于0.1mol/L。请你分析配制过程中可能引起该误差的原因是(填字母代号)
①容量瓶不干燥,含有少量蒸馏水②定容时俯视刻度线③定容时仰视刻度线④未冷却至室温就转移到容量瓶中⑤没有洗涤烧杯和玻璃棒
“碘钟”实验中,3I-+S2O82-=I3-+2SO42- 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是为了探究因素对化学反应速率的影响。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
| A.<22.0s | B.22.0~44.0s | C.>44.0s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。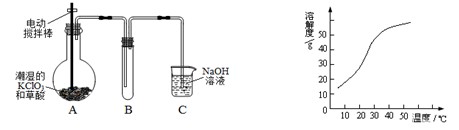
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有;B也必须添加温度控制装置,应该是装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是。
②原ClO2溶液的浓度为g / L(用含字母的代数式表示)。
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中有两处明显的错误是
①;②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水外,还需要加入少量的,其作用是。