二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为__________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_________(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.2%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠___________g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为__________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是_________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________。
某学生用下图的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。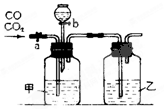
(1)甲瓶内盛溶液,乙瓶内盛溶液,分液漏斗内盛溶液。
(2)实验先分离出一氧化碳,方法是先关闭,再打开。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭,再打开。
10分)实验室需配制230mL 0.8mol/L的NaOH溶液,填空并回答下列问题:
(1)配制230 mL 1.0mol/L的NaOH溶液(容量瓶的规格通常有:50 mL、100 mL、250 mL、500 mL、1000 mL)
| 实际应称NaOH质量 |
应选用容量瓶的规格 |
实验中的所需仪器 |
| ①g |
②mL |
不需填写 |
(2)假设在配制过程出现如下其中的一种情况,而其他操作正确,则其中一种情况对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。
①若加蒸馏水时不慎超过了刻度;
②若定容时俯视刻度线_______;
③若在用托盘天平称量NaOH固体时砝码放在左盘。
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。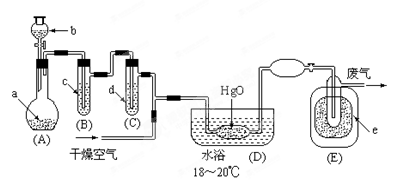
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中盛有深色固体试剂a是,分液漏斗中b试剂是。
(2)B中盛有液体c是 ,C中的液体d是 。
(3)D中发生化学反应的化学方程式是。
(4)E中的保温瓶中盛有致冷剂,它应是(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是,用这些不同的连接方式的主要理由是 。
(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙: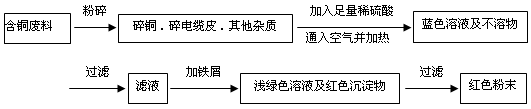
(1)两个方案中,符合当前生产中绿色化学理念的是方案,理由是。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:︰。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
I.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要的作用。
下列关于实验的叙述中正确的有。(选填字母)
| A.金属钠着火时,应立即用大量水扑灭 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH清洗 |
| C.蒸发结晶时应将溶液蒸干后再停止加热 |
| D.蒸馏时,应使温度计水银球伸入液面下 |
E. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F. 使用容量瓶前检查它是否漏水
G.配制溶液时,定容时俯视刻度线观察液面
H.焰色反应实验时,每做完一次实验,铂丝应先沾上稀盐酸放在火焰上灼烧到无色时,再做下一次实验。
II.某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,采用了不同的实验方法。(装置如下图所示)
(1)根据上图I、Ⅱ所示实验,能够达到实验目的的是(选填装置序号)。
(2)图III所示实验能够鉴别碳酸钠和碳酸氢钠这两种物质,请写出试管C中发生反应的化学方程式。
(3)图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的物质为,实验过程中的现象为。