(10分)某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L﹣1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____________式滴定管,可使用的指示剂为____________。
(3)样品中氨的质量分数表达式为_____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将__________(填“偏高”或“偏低”)。
(5)测定氯过程中,使用棕色滴定管的原因是_________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol•L﹣1,c(CrO42-)为__________mol•L-1。已知:Ksp(Ag2CrO4)=1.12×10-12
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价__________,制备X的化学方程式为__________;X的制备过程中温度不能过高的原因是__________。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)。a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数。
写出探究②中出现的所有离子反应方程式。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。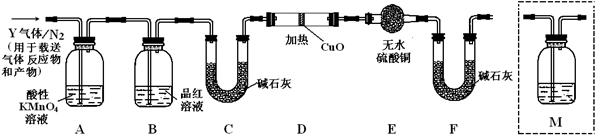
(3)装置B中试剂的作用是。
(4)分析Y气体中的Q2气体是如何生成的。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是。
.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
① A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
| A.KSCN溶液 | B.稀硫酸 |
| C.浓盐酸 | D.KMnO4溶液 |
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。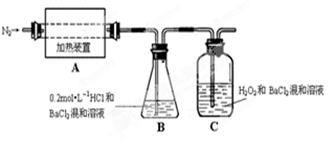
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O 2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如
2Na2O2+2CO2 ="=" 2Na2CO3+O2, Na2O2+CO = Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式: _________________;___________________。
(2)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(3)依上述规律,写出Na2O2与N2O5反应的化学方程式________________________________。
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O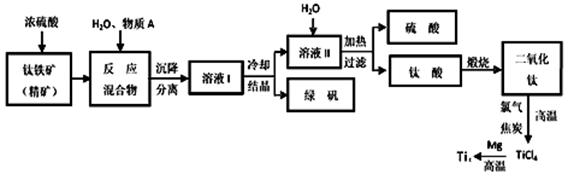
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。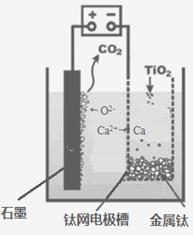
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)_________。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)装置中干燥管B的作用是_____________________________________。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(3)步骤⑤的目的是________________________________________。
(4)步骤⑦的目的是_______________________________________________。
(5)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。