硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S ="=" Na2S2O3 。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。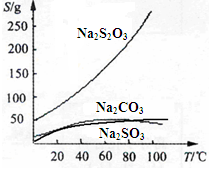
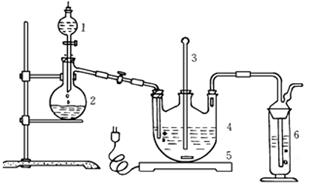
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为 ,装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为: ① Na2CO3+SO2=Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
① Na2CO3+SO2=Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶pH要控制不小于7的理由是: (用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
(3)为减少产品的损失,操作①为 ,操作②是过滤洗涤干燥,其中洗涤操作是用 (填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高 。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化: 。
③产品中Na2S2O3·5H2O的质量分数为 。
将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中加热,充分应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除 外还可能含有
外还可能含有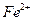 。若要确认其中的
。若要确认其中的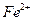 ,应选用(填序号)。
,应选用(填序号)。
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 |
| C.浓氨水 | D.酸性 溶液 溶液 |
丙同学认为气体Y中除 外还可能含量有
外还可能含量有 和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。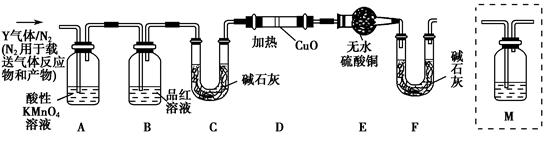
(2)装置B中试剂的作用是。
(3)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(4)为确认Q的存在,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(5)如果气体Y中含有 ,预计实验现象应是。
,预计实验现象应是。
过氧 化氢对环境友好,性质多样,有很重要的研究和应用价值。
化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积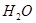
 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号] |
条件 |
现象 |
结论 |
|
| 温度/℃ |
催化剂 |
|||
| 1 |
40 |
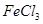 溶液 溶液 |
||
| 2 |
20 |
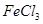 溶液 溶液 |
||
| 3 |
20 |
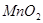 |
||
| 4 |
20 |
无 |
实验1、2研究的是______________对 分解速率的影响。
分解速率的影响。
实验2、3的目的是____________________________。
实验中可以表明该反应速率差异的现象是______________。
②实验室用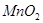 做该反应的催化剂,使用如下图所示装置的A部分制备
做该反应的催化剂,使用如下图所示装置的A部分制备 ,避免反应过于剧烈的操作是______________。
,避免反应过于剧烈的操作是______________。
(2) 与水反应也可生成
与水反应也可生成 ,某同学取
,某同学取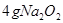 样品与过量水反应,待反应完全终止时,得
样品与过量水反应,待反应完全终止时,得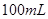 溶液X和
溶液X和 (已折算为标准状况),该同学推测样品中含有杂质或反应中生成
(已折算为标准状况),该同学推测样品中含有杂质或反应中生成 ,并进行实验研究。
,并进行实验研究。
①取少量X于试管中,滴加 溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。
溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。
②通过如上图所示整套实验装置测定 样品的纯度,假设所含杂质不参加反应,取25
样品的纯度,假设所含杂质不参加反应,取25 ,滴入烧瓶内使其与过量
,滴入烧瓶内使其与过量 酸性溶液反应,最终生成
酸性溶液反应,最终生成 (已折算为标准状况),则此样品中
(已折算为标准状况),则此样品中 的质量分数是____________________________。
的质量分数是____________________________。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________ mL。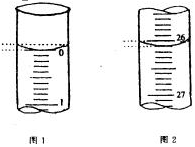
(4)某学生根据三次实验分别记录有关数据如下表: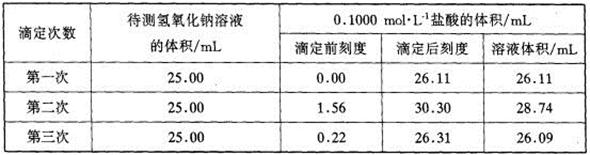 请用上述数据列式计算该氢氧化钠溶液的物质的量浓度。
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度。
下图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的装置图,请回答下列问题: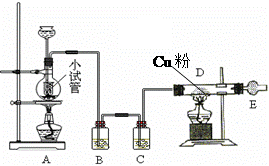
⑴ 小试管的作用是;烧瓶中发生反应的化学方程式是;
⑵ B瓶中的溶液是,其作用是;C瓶中盛放的溶液是,其作用是。
⑶ 玻璃管D中反应的现象是。
⑷ 干燥管E中盛有碱石灰,其作用是。
⑸ 开始实验时,应先点燃处(填“A”或“D” )的酒精灯,当时再点燃另一处的酒精灯。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为;漂白粉有效成分为(填名称);瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。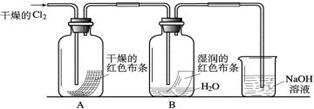
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是;其中发生的反应的化学方程式为。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是。
c.烧杯中溶液所起的作用是,烧杯中所发生反应的化学方程式为。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
mL。